El Cero Absoluto:Los Superconductores y la Superfluidez, Concepto
Concepto del cero absoluto: Los superconductores y la superfluidez
La física demuestra que el calor no es otra cosa que el estado de agitación de las moléculas de un cuerpo.
Cuando éstas se mueven con gran energía, la temperatura aumenta; cuando su velocidad disminuye, la temperatura desciende.
Es lógico suponer que cuando las moléculas queden inmóviles no se podrá lograr ya un trío mayor.
En otras palabras, el frío no es otra cosa que la ausencia de calor.
El cero absoluto, es decir, la temperatura más baja posible, se encuentra a 273,16° bajo cero.
Hace ya casi dos siglos que los científicos saben que el cero absoluto se halla cerca de los 273° bajo cero; en efecto, observaron que los gases más livianos —como el helio y el hidrógeno, es decir, aquellos que más se acercan a un ‘gas ideal” formado solamente por puntos, sin volumen, en movimiento— disminuían 1/273 de su volumen a O °C, cada vez que la temperatura bajaba en 1º.
Inversamente cuando la temperatura se elevaba su volumen crecía, por cada grado, en 1/273 de su volumen a 0°C.
Esta disminución, fija y constante, implicaba que el volumen de un gas ideal llegaría a ser nulo cuando se llegara al cero absoluto.
En otras palabras, sus moléculas ya no chocarían entre sí, y se reunirían inmóviles en un grupo, cuyo volumen seria cero si las moléculas carecieran de extensión.
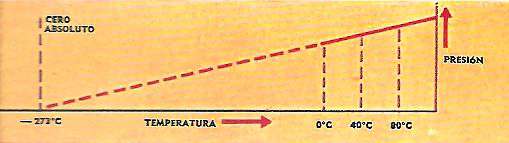
Algo semejante ocurre cuando se calienta o enfría un gas en un recipiente cerrado; como le es imposible aumentar o disminuir de volumen, es su presión la que aumenta o disminuye 1/273 de la presión a 0°C., por cada grado de variación de temperatura.
 Esto es lo que ilustra el diagrama de arriba sobre fondo amarillo.
Esto es lo que ilustra el diagrama de arriba sobre fondo amarillo.
Kelvin estableció una escala de temperaturas que arranca del cero absoluto, de modo que una temperatura de 10 °C. de nuestra escala habitual corresponde a 283 °K ó grados Kelvin.
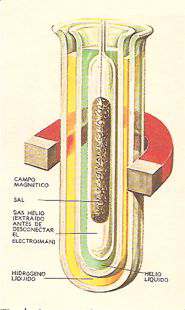
Las temperaturas más bajas se han obtenido en uno sal (alumbre) mediante helio liquido, dentro del campo magnético de un electroimán.
Cuando se anula el campo magnético la sal, que se encuentra ya a muy baja temperatura, se enfrío aún más.
La razón es que el campo magnético eleva lo temperatura de la sal, y al suprimirlo se obtiene un enfriamiento suplementario.
La camisa de hidrógeno liquido mantiene el conjunto o unos pocos grados sobre el cero absoluto. (ver imagen izquierda)
El concepto de un cero absoluto de temperatura surgió por vez primera en relación con experimentos con gases; cuando se enfría un gas sin variar su volumen, su presión decrece con la temperatura.
Aunque este experimento no puede realizarse más allá del punto de condensación del gas, la gráfica de los valores experimentales de presión frente a temperatura se puede extrapolar hasta presión nula.
La temperatura a la cual la presión sería cero es el cero absoluto de temperatura.
CÓMO SE OBTIENEN TEMPERATURAS BAJÍSIMAS
Jamás se alcanzó el cero absoluto, pero se llega a unas pocas milésimas de grado de él.
La razón es simple: las disminuciones de temperatura suelen obtenerse igualando la temperatura del cuerpo que se enfría con la de otro que está aún más frío, y es bien sabido que, dividiendo una cantidad, aunque se repita la operación miles de veces nunca se puede llegar al cero.
Así, si se divide la cifra en dos partes iguales y el resultado en otras dos y así sucesivamente, se logran cifras extremadamente pequeñas pero nunca nulas.
Antes de explicar cómo se obtienen los fríos extremos, recordemos que las moléculas de un gas son como pelotas que chocan contra las moléculas vibrantes del recipiente hasta igualar su energía con las de éste.
Como primera fase se comprime el gas de manera que el mismo volumen esté ocupado por muchas moléculas y tenga mucha más energía: el gas, entonces, se calienta, pues la temperatura expresa la densidad de energía por volumen.
Dicho gas caliente, se deja enfriar, y sus moléculas pierden velocidad, una vez enfriado se dilata bruscamente y entonces se pone muy frío, porque tiene pocas moléculas con poca energía por unidad de volumen.
La temperatura mas baja posible es 273.15 grados bajo cero, que es lo que se conoce como cero absoluto.Esta temperatura es imposible de alcanzar, pero los científicos están investigando cuanto es posible acercarse.
Este gas muy frío sé utiliza para enfriar otro gas a temperatura normal, el que luego es, a su vez, dilatado y enfriado aún más, y sirve para enfriar a un terco gas que también es dilatado, y así sucesivamente.
Con este procedimiento se ha logrado licuar todos los gases y solidificar todas las sustancias, menos el helio (éste necesita una presión adicional para convertirse en sólido).
LOS SUPERCONDUCTORES:
Kammerling Onnes sumergió un anillo de mercurio solidificado en un baño de helio líquido y comprobó que el metal perdía toda resistencia eléctrica.
Si se inducía una corriente en el anillo, ésta lo recorría indefinidamente: dos años después de rotación ininterrumpida la intensidad de la corriente no había variado.
El metal se había convertido en superconductor.
Lo mismo ocurre con la temperatura: el helio líquido transmite el calor doscientas veces más rápidamente que el cobre.
En 1933, W. Meissner y R. Oschenfeld encontraron experimentalmente que un superconductor se comporta de manera tal que nunca permite que exista un campo de inducción magnética en su interior.
En otras palabras, no permite que un campo magnético penetre en su interior. El campo magnético en el interior de un superconductor no sólo está congelado, sino que vale siempre cero.
DEL LABORATORIO A LA INDUSTRIA:
Las dimensiones de las calculadoras electrónicas, que funcionan a temperaturas muy bajas, son asombrosamente reducidas, debido a la gran conductibilidad que adquieren los metales, lo que permite utilizar cantidades mucho menores; además, si la señal eléctrica sólo necesita recorrer 5 cm. en lugar de 30 cm., como ocurre en una calculadora común, el tiempo de transmisión de la señal se reducirá de un millonésimo de segundo a la sexta parte, y la calculadora será seis veces más veloz.
La potencia de un electroimán depende de la intensidad de la corriente que lo recorre; pero a la temperatura normal ésta tiene un límite porque las espiras de la bobina se fundirían.
Con las aleaciones de niobio y estaño, y ahora de niobio y circonio, se puede lograr, a muy bajas temperaturas(18°K ósea 255 °C bajo cero) intensidades de 200.000 amperios por cm².
Lo curioso es que la aleación de este filamento (que costó mucho poner a punto por su fragilidad) es asegurada por un metal común, porque la resistencia de la aleación es tan baja que la corriente pasa por ella sin hacer uso del metal, habitualmente conductor.
VISIONES DEL FUTURO:
Además de obtenerse memorias electrónicas cada vez más pequeñas, existen otras aplicaciones industriales en vías de realización.
Sabemos que cuando se acerca un imán a un conductor se genera una corriente eléctrica: si el conductor está súper enfriado, la corriente es permanente y engendra, a su vez, un campo que rechaza al imán, de manera que éste flota en el vacío.
Aprovechando esta propiedad se estudia la realización de un giróscopo que rotaría en el vacío, funcionando, así, sin ninguna fricción y gozando de una excelente sensibilidad.
Un proyecto más atrevido es el de las corrientes en conserva.
En un superconductor se puede generar una corriente que circule indefinidamente y aprovecharla cuando se la necesita.
Se calcula que una corriente de 100.000 amperios podría brindar una energía de unos 1.300 kilovatios/hora, suficiente para la propulsión de un vehículo mediano, sobre un recorrido de unos cuantos miles de kilómetros.
La recarga del dispositivo se efectuaría en pocos segundos.
Además, se en-cara la utilización de los metales superconductores para constituir reservas de energía eléctrica, a fin de distribuirlas en las redes urbanas en los momentos de mayor consumo, sin tener que recurrir a máquinas adicionales, a combustibles especiales o a reservas de agua a alto nivel.
LA SUPERFLUIDEZ O LA HEREJÍA DEL HELIO:
En el cero absoluto las moléculas están inmóviles.
Se explica fácilmente que una corriente eléctrica, que consiste en electrones que traspasan y sortean las moléculas, atraviese más fácilmente los cuerpos. Pero los átomos no están inmóviles.
De allí que, para lograr los máximos enfriamientos, se trate de orientar o frenar los átomos mediante poderosos imanes, como muestra la ilustración.
Cerca del cero absoluto y a la presión normal el hidrógeno es sólido, porque los lazos entre sus átomos son bastante fuertes.
En cambio, el helio, gas noble sin afinidades químicas y sin problemas electrónicos (su órbita periférica está completa), sigue en estado liquido.
Pero su viscosidad es 10.000 veces menor que la del hidrógeno gaseoso.
Este estado, denominado de superfluidez, da origen a una serie de fenómenos realmente asombrosos.
Si se toma un frasco con helio liquido y se lo sumerge parcialmente en otro baño de helio líquido, se ve al helio que escala las paredes del vaso para ir hacia el baño, o viceversa, hasta igualar los niveles, sin realizar, aparentemente, ningún esfuerzo y como si desafiara las leyes de la gravedad.
En cambio, si se hace girar el vaso dentro del baño de helio, hay un frotamiento, y la viscosidad que se mide corresponde a una cifra normal.
Más aún, si un recipiente hermético lleno de helio liquido y con una válvula inferior se calienta después de sumergirlo en helio, la válvula se abre para dar  salida al helio, pero el nivel no baja porque —como lo predijo Euler hace ya doscientos años— la viscosidad nula del liquido que entra no vuelve a cerrar la válvula, pues no roza contra ella.
salida al helio, pero el nivel no baja porque —como lo predijo Euler hace ya doscientos años— la viscosidad nula del liquido que entra no vuelve a cerrar la válvula, pues no roza contra ella.
Esta experiencia, y muchas otras, han sido explicadas por los grandes físicos modernos, especialmente Lev Landau (imagen) , el primer sabio que recibió el premio Nobel fuera de Suecia, mientras convalecía en un hospital de Moscú de un gravísimo accidente, que obligó a mantenerlo con vida, durante meses, mediante aparatos de circulación y respiración artificiales.
Después de llegar cuatro veces a la muerte clínica, Landau está hoy salvado por la misma ciencia, que lo recompensa como uno de sus más brillantes servidores.
PARA SABER MAS...
Hacia el cero absoluto
Los tres estados en que existe la materia (sólido, líquido y gaseoso) constituyen un fenómeno fácilmente observable.
El ejemplo clásico es el agua, que a diario vemos como hielo, agua líquida y vapor de agua.
También puede pasar del estado sólido al gaseoso sin licuarse en el proceso, como sucede cuando la nieve depositada desaparece lentamente al calor del sol, incluso cuando de la temperatura del aire se mantiene por debajo del punto de congelación.
Durante la segunda mitad del siglo XIX, los científicos comenzaron a estudiar sistemáticamente las condiciones que rigen las transiciones de un estado a otro, sobre todo en la escuela holandesa de H.
Kamerlingh Onnes, que investigó las propiedades de los líquidos y los gases en las más variadas temperaturas, especialmente en las extremadamente bajas.
En 1894, Onnes fundó el famoso laboratorio criogénico (del griego, «productor de frío») de la Universidad de Leiden, y en 1911 descubrió un fenómeno notable y bastante inesperado a temperaturas muy bajas, los metales dejan de oponer resistencia al paso de una corriente eléctrica, de manera que una vez establecida, la corriente sigue pasando indefinidamente.
Este fenómeno, al que Onnes dio el nombre de superconductividad, le valió el premio Nobel en 1913.
Se convirtió así en el precursor de una nueva rama de la física, la criogenia, que ha arrojado nueva luz sobre la estructura de la materia y ha producido numerosas e importantes aplicaciones tecnológicas.
Sin embargo, para comprender la importancia de las investigaciones llevadas a cabo por H. Kamerlingh Onnes, es preciso decir algo acerca de las temperaturas en cuestión, ya que son totalmente ajenas a la experiencia humana corriente, incluso en las profundidades del invierno siberiano o antártico.
El calor es esencialmente una forma de movimiento (la agitación de las partículas en el nivel molecular) y la temperatura es la medida del grado de agitación.
Cuando la temperatura desciende, el movimiento se vuelve más lento, de donde se deduce que habrá un punto en que se detenga por completo, en una temperatura correspondiente a cero.
En 1851, William Thomson (lord Kelvin) señaló que las constantes termodinámicas indican que ese «cero absoluto» corresponde a una temperatura de aproximadamente —273 °C.
Esta observación determinó la introducción de una nueva escala de temperaturas (la escala Kelvin), que desde entonces se ha utilizado ampliamente en la investigación científica.
La escala parte del cero absoluto, expresado como O °K.
En la época era impensable lograr semejante temperatura, que aun así constituía un punto de referencia para los interesados en la física de bajas temperaturas, en especial para los que estudiaban la licuefacción de los gases.
Se sabía que era posible licuar ciertos gases por el procedimiento de someterlos a altas presiones, siempre que se mantuviera por debajo de la llamada «temperatura crítica».
Algunos gases, como el amoniaco, se licuaban por compresión a temperaturas normales; pero otros no lo hacían, por mucho que se hubieran enfriado previamente.
Este tipo de gases recibían el nombre de «gases permanentes», pero existía la sospecha de que no se licuaban sencillamente porque sus temperaturas críticas eran extremadamente bajas.
Para licuarlos, era preciso encontrar nuevas técnicas de refrigeración intensa.
Uno de los procedimientos empleados era el que aprovechaba el efecto Joule-Thomson, consistente en enfriar y comprimir el gas, para luego dejarlo escapar por un pequeño orificio, lo cual consigue enfriarlo un poco más.
En la vida cotidiana, este efecto se observa cuando se deja salir el gas de un espray y el cilindro se enfría perceptiblemente.
Sin embargo, incluso a principios de siglo, quedaban todavía algunos gases con temperaturas críticas muy bajas que había sido imposible licuar.
El que presentaba más dificultades era el helio con una temperatura crítica de 5 °K (—268 °C).
Onnes superó finalmente este obstáculo en el año 1908 y uno de sus discípulos, W.H. Keesom, consiguió solidificarlo.
En aquella época, los gases líquidos eran un objeto de laboratorio, pero el inventor e industrial alemán Cari von Linde, director de una empresa de refrigeración en París, creyó en su gran potencial industrial y en 1895 diseñó unas instalaciones para la producción de aire líquido a gran escala.
De esta forma, durante la primera década de este siglo, surgió una nueva y importante industria de gases líquidos, sin precedentes en el siglo XIX.
El oxígeno líquido, destilado del aire líquido, encontró amplia aplicación en los quemadores de oxiacetileno utilizados para soldar metales y, en menor escala, también comenzó a utilizarse en medicina.
Sin embargo, su principal aplicación llegó después de la Segunda Guerra Mundial, cuando sustituyó al aire en el proceso de fabricación del acero.
Fuente Consultada: Tecnirama






