El Agua:Caracteristicas,Propiedades Físicas y Curiosidades
El Agua:Caracteristicas,Propiedades Físicas y Curiosidades
PROPIEDADES:
1-Temperatura de Ebullición y Fusión
2-Densidad
3-Presión
4-Calor Especifico
5-Tensión Superficial
6-Constante Dielétrica
EL AGUA es el compuesto químico más común de la Tierra.
Existe tanta que si la corteza terrestre fuese absolutamente plana, los océanos cubrirían todo el planeta a una profundidad uniforme de casi 2.5 km.
El agua es la única sustancia que se puede encontrar, de manera natural, en los tres estados de la materia: sólido, líquido y gaseoso (vapor).
Y según afirman los científicos, en ella se inició la vida hace millones de años.
Se trata de una sustancia excepcional, porque naturalmente se encuentra en las tres fases: sólida, líquida y gaseosa.
En este sentido, si se compara la molécula de agua con otras similares, parecería que su fase dominante es la gaseosa en lugar de la líquida.
Sin embargo, esta última es la que se presenta en el rango de temperatura que existe en una gran mayoría de la superficie del planeta.
Esto se debe a la formación de dipolos.
Además, tiene otras propiedades extraordinarias que veremos a continuación.
UN POCO DE HISTORIA...
La Tierra se formó hace unos 5.000 millones de años.
Mil millones de años más tarde, el oxígeno se mezcló con hidrógeno en la primitiva atmósfera y se formó el agua.
Gradualmente, las moléculas de agua fueron ocupando la atmósfera en forma de vapor invisible, el cual, al condensarse, produjo la lluvia.
La Tierra era entonces mucho más caliente que ahora y, por consiguiente, la lluvia, al hacer contacto con ella, se convertía inmediatamente en vapor y volvía de nuevo a la atmósfera.
Así continuó sucediendo hasta que la Tierra se fue enfriando y, en consecuencia, el agua se fue depositando en las hondonadas, lo que originó que poco a poco se fueran formando primero los lagos, luego los mares y, finalmente, los océanos.
Y fue aquí, en los océanos, donde se originó y se desarrolló por vez primera la vida sobre la Tierra.
Pero, sin unas condiciones precisas y adecuadas, nunca se hubiera producido la vida. Así, si la Tierra hubiera sido más pequeña, la gravedad no habría sido suficiente para atraer y retener las moléculas de agua.
Si ponemos, por ejemplo, un recipiente con agua en un sitio templado y seco de la casa, pronto se secará; sin embargo, las moléculas de agua no se pierden, sino que se mantienen en suspensión en el aire que respiramos.
Si se hiciera lo mismo en la Luna, el agua se evaporaría paulatinamente y se perdería en la inmensidad del espacio celeste.
El agua es una de las sustancias más comunes, aunque también, por varios motivos, una de las más complejas. Puede ser líquida, sólida (hielo) o gaseosa (vapor).
En todas estas formas, el agua presenta diferentes e importantes propiedades, que son objeto de estudio de miles de científicos.
El agua es un líquido inodoro, incoloro e insípido que resulta imprescindible para el desarrollo de procesos vitales, desde el ámbito celular hasta la propia vida humana.
Buena prueba de ello es el hecho de que aproximadamente el 70% del peso del cuerpo humano está constituido por agua.
Formas en que se presenta el agua:
La característica relativamente más simple del agua es que, en estado puro, constituye un compuesto químido formado por dos átomos de hidrógeno unidos a uno de oxígeno.
Científicamente, esto se expresa con la fórmula H2O.
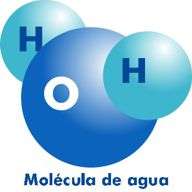
Elementos químicos de una molécula de Agua: 2 átomos de hidrógeno y 1 de oxígeno
El agua está compuesta por dos átomos de hidrógeno y uno de oxígeno, y su fórmula química es H20.
Su molécula, triangular, presenta un átomo de oxígeno en uno de sus vértices y en los restantes los de hidrógeno.
La unión de cada oxígeno con los otros dos integrantes de la molécula tiene lugar mediante un enlace covalente; así pues, el oxígeno comparte un par de electrones con cada uno de los hidrógenos.
Tanto el agua evaporada como el hielo y el agua líquida son casi completamente transparentes; y si no lo son, es debido a las impurezas o sustancias disueltas, e incluso a las burbujas de aire u otros gases que contienen.
El agua pura es insípida, pero la que sale del grifo suele contener unas cantidades mínimas de sustancias disueltas que hacen que al bebería resulte más agradable.
Podemos conseguir agua casi pura hirviéndola y condensando el vapor en una superficie fría; es lo que se llama agua destilada.
También el agua de lluvia es casi pura, aunque la precipitación en zonas uroanas es muy probable que arrastre parte de las impurezas de la atmósfera.
Hay dos tipos bastante infrecuentes de agua.
De cada 500 átomos de hidrógeno, aproximadamente uno es de deuterio, una variedad de hidrógeno que pesa el doble del normal, y cuando este átomo se une a uno de oxígeno se obtiene agua pesada (D2O).
El otro tipo es el denominado óxido de tritio (T2).
Sustancias que contiene el agua:
Se disuelven más sustancias en agua que en cualquier otro líquido. Esto se debe a que sus moléculas tienen un arreglo de átomos poco común que las convierte en diminutos "imanes", con una carga eléctrica positiva de un lado y una negativa del otro.
Dado que las cargas eléctricas opuestas se atraen, las moléculas del agua son capaces de unirse por cualquiera de sus lados a las de otras sustancias, sin importar la carga eléctrica de éstas.
Así, compuestos tan diferentes como sal, azúcar y alcohol se disuelven fácilmente en agua.
En este sentido, el agua es extremadamente "adherible" y disuelve otros materiales separándoles las moléculas.
Si vertemos unos granitos de sal común (cloruro de sodio) en un poco de agua y agitamos bien la mezcla, llegará un momento en que la sal, por haberse disuelto, dejará de verse; pero el agua sabrá salada.
Esto mismo es lo que ha estado sucediendo en los océanos desde su formación.
El sol y el viento evaporan parte del agua de la superficie del mar, pero las demás sustancias que contiene permanecen; este agua evaporada cae en forma de lluvia en los campos, y al correr entre las rocas disuelve y arrastra una pequeña parte de ellas: es lo que llamamos sales, aunque no todas tienen por qué ser necesariamente cloruro de sodio.
El agua cargada de sales vuelve de nuevo al mar, incrementando un poco más el contenido de minerales disueltos que ya posee.
Además, por sus insólitas propiedades eléctricas, las moléculas de agua se fijan unas a otras con extraordinaria tenacidad.
Se requiere de gran cantidad de energía para separarlas y, así, cambiar su estado de, digamos, sólido a líquido.
Por esta razón, a diferencia de muchos otros compuestos simples que también contienen hidrógeno, el agua se derrite y hierve a altas temperaturas. El metano, por ejemplo, hierve a -161°C, muy por debajo del punto de congelación del agua.
PROPIEDADES FÍSICAS:
La importancia del agua es tal en el universo que los científicos se sirven de ella como patrón en los sistemas de medida de densidad y temperatura.
La densidad o peso específico de una sustancia es su masa en relación a la unidad de volumen.
La unidad de masa o peso es el gramo (g), que se define como la masa de un mililitro (0,001 de un litro, o exactamente un centímetro cúbico) de agua a la temperatura de 3,98 °C.
La temperatura debe consignarse, pues la densidad del agua varía al calentarse o enfriarse.
Temperaturas
La temperatura a que se hiela o hierve el agua pura a la presión atmosférica del nivel del mar es la base de nuestra escala termométrica.
En la escala Celsio o Centígrada común, el agua se congela a 0º y hierve a 100°. Si se toma agua pura, completamente desprovista de gas disuelto, y se calienta con mucho cuidado, sin agitarla, se puede elevar la temperatura hasta 180 °C y comprobar que permanece en su estado líquido.
Este agua sometida a tan elevadas temperaturas parece como si de pronto hiciese explosión, pasando a continuación a convertirse en vapor.
Cada partícula de agua se expande súbitamente a unas 1.700 veces su volumen líquido.
Del mismo modo, si se enfría el agua con sumo cuidado, puede alcanzarse una temperatura algo por debajo de los 0º, sin que por ello llegue a helarse; pero en seguida se congela y se expande también.ç
Este mismo proceso es el que tiene lugar cuando se dice que las cañerías se han reventado en una helada o que las botellas de leche, por ejemplo, se han roto; y la causa no es otra que la expansión que experimenta el agua al congelarse.
Densidad:
A excepción del hielo, cuya densidad es menor que la del agua, la mayor parte de las materias son más densas en estado sólido que en estado líquido.
El hielo común tiene una densidad de 0,917, comparado con un valor de 1,0 del agua líquida; de ahí que el hielo, en cierta medida, flote. Así, cuando vemos un iceberg, hemos de tener en cuenta que es sólo una mínima parte lo que asoma a la superficie; debajo se oculta una masa ocho o nueve veces mayor.
Como sucede con casi todas las demás sustancias, la densidad del agua disminuye al calentarla; por eso, el agua más templada sube a la superficie del mar, y la más fría, con mayor peso, permanece debajo.
La temperatura en que el agua pura presenta la máxima densidad es de unos 4 °C (exactamente 3,98 °C), y esto también es un hecho excepcional: si se la somete a temperaturas inferiores, al enfriarse, su densidad disminuye, al revés de lo que podría esperarse.
Esta propiedad es vital para los animales marinos de las regiones frías, pues el agua de la superficie, al enfriarse por estar en contacto con el aire frío, se vuelve más densa y se hunde lentamente formando una capa con una temperatura de apenas de 4 °C que no puede ser desplazada.
El agua superficial, menos densa, es la que primero se congela. En la capa profunda, que permanece a 4 °C, puede subsistir la vida hasta el deshielo de la primavera.
Si el agua no poseyera esta propiedad casi mágica, todo el agua de un lago se congelaría hasta el fondo.
La densidad media del agua oceánica es de 1,014, pero varía tanto en función de su temperatura como de su salinidad.
Presión:
Los científicos han descubierto que existen muchas clases diferentes de agua y también ciertas variedades de hielo de mayor densidad que ésta.
Se puede hacer hielo comprimiendo el agua a presiones extremas antes de congelarla; incluso, después de haberse formado el hielo, puede licuarse comprimiéndolo.
Una presión de 15,5 MPa (millones de Paséales o 0,155 toneladas por cm2) reduce el punto de congelación en 1 °C.
El filo de unos patines, por ejemplo, hace tal presión sobre el hielo que lo funde momentáneamente, permitiendo así que el patinador se deslice grácilmente sobre una delgadísima capa de agua.

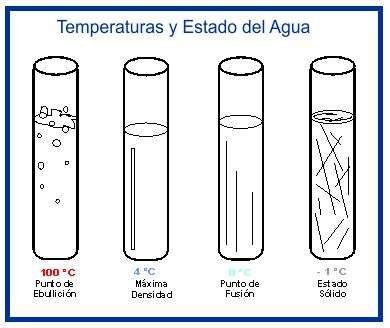
La densidad del agua varía con la temperatura. Igual masa ocupa diferente volumen a distintas temperatuas. El hielo es menos denso que el agua hirviendo, y ésta alcanza la máxima densidad a 4 °C.
Cristal del Hielo

El hielo es cristalino y forma figuras hexagonales (de 6 lados).
Este mismo es el efecto que se produce al congelarse la humedad depositada, por ejemplo, en una ventana.
En estado sólido es singular, pues la mayoría de las sustancias sólidas son más densas que su forma líquida. Para solidificarse, las moléculas se acercan y se unen.
Sin embargo, las moléculas del agua , al unirse para producir un cristal de hielo (arriba), crean en su figura un hueco entre ellas, ampliando el espacio que ocupan.
Por lo tanto, el hielo es menos denso que el agua, y por eso los cubos de hielo flotan.
------------- 00000 ------------
• Calor Especifico:
Con un valor de 4,185 joule/g °C el agua es la mayor de todas las sustancias sólidas y líquidas, a excepción del litio, del hidrógeno y del amoníaco licuado.
Su elevada capacidad para almacenar calor hace que los océanos puedan regular la temperatura terrestre y tener un papel estabilizador en las variaciones de temperatura de la atmósfera, eliminando los fríos y los calores extremos y permitiendo la existencia de las especies vivas muy sensibles.
• Calor latente de fusión.
Su valor de 79 kcald es el mayor, exceptuando el del amoníaco.
Esto permite un efecto de termostato en las proximidades del punto de fusión, lo que se relaciona con la interacción entre la criosfera y la hidrosfera, en relación con los fenómenos de erosión.
• Calor latente de evaporación.
Es de 547 kcal/1 a 100 °C y representa el mayor valor conocido. Resulta relevante en la transferencia de calor y de vapor de agua a la atmósfera.
• Tensión superficial.
Esta magnitud a 20 °C alcanza un valor de 72,76 dyn/cm. Es el valor máximo de todos los líquidos a esa temperatura, y tiene importancia en fenómenos de superficie y en la formación de gotas.
La tensión superficial explica fenómenos biológicos tales como el movimiento de las chinches de agua en la superficie del agua.
• Constante dieléctrica.
A 20 °C y una atmósfera alcanza un valor de 80,36.
Es la mayor en líquidos y tiene especial interés para facilitar la disociación de moléculas inorgánicas. Por ejemplo, para mantener la presión osmótica y el equilibrio ácido-base de la célula, son importantes las sales disociadas en aniones (CP) y cationes (Na+, Mg++).
La retención de iones produce un aumento en la presión osmótica y, por lo tanto, la entrada de agua a la célula, viscosidad dinámica.
Tiene un valor relativamente alto, de 0,01 g/cm3 a 20 °C y una atmósfera, aproximadamente cien veces mayor que el aire.
Como consecuencia, el agua es un medio que ofrece resistencia a los organismos que deben desplazarse en ella, pero a su vez facilita la suspensión de las comunidades planctónicas.
Poder disolvente de las sales y del oxígeno.
El agua es la sustancia que más solutos, gases, líquidos y sólidos es capaz de disolver y además de hacerlo en mayor proporción, por lo que nunca se encuentra en estado puro en la naturaleza.
Incluso el agua de lluvia, que es la de más baja contaminación de otras sustancias, contiene gases y un 0,003% de minerales disueltos, como calcio, magnesio y sodio.
Así como la solubilidad de las sales aumenta, en general, al aumentar la temperatura, ocurre lo contrario con los gases.
A medida que disminuye la temperatura, la solubilidad del gas aumenta (tengan en cuenta al respecto, los postulados de la teoría cinética).
Mientras que se disuelven 370 g de cloruro de sodio (NaCl) en un litro de agua a 20 °C, a la misma temperatura se disuelven 9 mg de oxígeno en un litro de agua.
La situación se modifica si la presión aumenta, ya que la solubilidad del gas aumenta.
Así, la trucha y el salmón no pueden vivir en agua, cuya temperatura es mayor a 15 °C.
Si bien el oxígeno se forma en el agua a partir de la fotosíntesis producida por las algas verdes, la mayor concentración proviene de la disolución del oxígeno contenido en la atmósfera, disolución que es favorecida por el movimiento de las aguas.
Los peces y otros animales acuáticos, así como las bacterias aeróbicas, necesitan del oxígeno para vivir, ya que lo utilizan para respirar.
Las bacterias aeróbicas (descomponedoras) transforman la materia orgánica disuelta en el agua en materia inorgánica y dióxido de carbono (CO2).
Cuando la concentración de materia orgánica es alta, la riuanda de oxígeno por parte de las bacterias pone en riesgo la vida en el bioma acuático.
Para que un pez pueda vivir, necesita aproximadamente 4 mg de oxígeno por litro de agua; si las bacterias hacen disminuir esta concentración, el pez muere por asfixia (o anoxia).
Tal vez por muchas de las razones enumeradas, el agua es el compuesto químico más abundante en los seres vivos y el principal componente del citoplasma celular.
Por otra parte, ningún ser vivo puede sobrevivir sin agua, y cada uno tiene su modo particular de obtenerla y aprovecharla.
El organismo humano está constituido sobre todo por agua, y su contenido se encuentra en relación con la edad y con la actividad metabólica de ese organismo; en el embrión es mayor (90-95%) y disminuye progresivamente en el adulto (entre 60% y 70%). Las dos partes riel peso del hombre y de la mujer consisten en agua.
El cerebro, por otra parte, está constituido por un 99% de agua, mientras que el esqueleto, por un 44%. La necesidad diaria de agua de un adulto es entre 2,5 y 2,7 litros.
La función de agua en el cuerpo humano es mantener la disolución de las enzimas y el resto de sustancias orgánicas de la célula.
Participa en el proceso digestivo y en el mantenimiento de la temperatura corporal.
Transporta los nutrientes en la sangre y ayuda a eliminar los desechos metabólicos.
------------- 00000 ------------
EL CONGELAMIENTO DE LA SUPERFICIE DE UN LAGO:
El agua también es extraña por la forma en que se congela. Casi todos los líquidos se congelan de abajo hacia arriba; es decir, conforme se enfrían, su densidad aumenta y las capas más calientes, al ser más ligeras, suben.
Sin embargo, el hielo se forma primero en la superficie del agua. Por ejemplo, la temperatura del agua de un lago puede ser de 10°C en otoño; a medida que el frío viento de invierno sople sobre el lago, la capa superior del agua se condensará y comenzará a hundirse.
A diferencia de otros líquidos, el agua alcanza su máxima densidad a los 4°C, por encima del punto de congelación. A esta temperatura el movimiento del agua del lago se detendrá.
La capa superior se enfriará más y se tornará menos densa, pero no se hundirá, debido a que el agua que esté debajo será más densa aún.
Si el viento es muy frío, la capa superior se enfriará tanto que se congelará.
A menos que el invierno sea extremadamente frío, esta capa de hielo protegerá el lago de la temperatura fría del exterior y evitará que se congele totalmente.
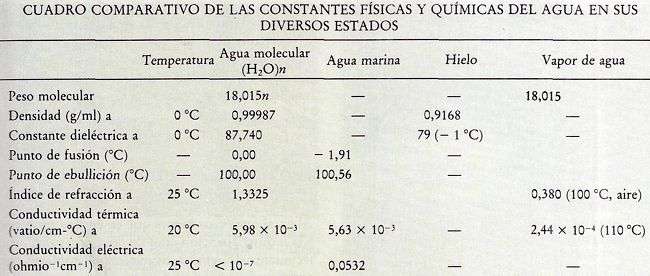
La siguiente tabla indica los valores de las constantes físicas y químicas, como peso molecular, densiad, constante dieléctrica, punto de fusión y ebullición , y otros datos del agua en sus diversos estados.
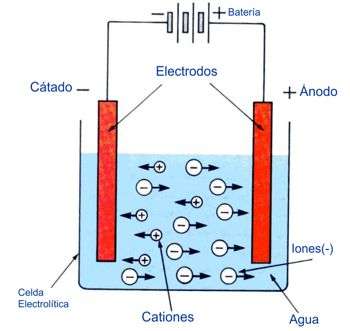
Electrólisis
Conectando un circuito eléctrico a dos electrodos inertes (conectores en los que la electricidad entra o sale por una disolución) sumergidos en agua absolutamente pura, es imposible que pase corriente.(ver proceso)
Pero si se añade al agua un poco de ácido, se produce inmediatamente una abundancia de iones liberados capaces de conducir electricidad, y surge también un chorro de burbujas de los electrodos hacia la superficie.
Del electrodo negativo, llamado cátodo, sale doble cantidad de gas que del positivo, llamado ánodo.
Mediante una serie de ensayos, podemos comprobar que del ánodo sale oxígeno y del cátodo hidrógeno, y así averiguar qué ingredientes componen el agua.
Cuba Electrolítica
Si se acercaran accidentalmente los dos gases a una cerilla encendida, se produciría una violenta explosión y los gases se volverían a convertir en agua.
Las aplicaciones industriales de la electrólisis reciben el nombre de electroquímica.
Estas aplicaciones son cada día más importantes: el afino del cobre y del cinc; la obtención del cloro; etc.
EL AGUA DE MAR:
En el agua de mar se encuentra el 75% de los elementos químicos naturales, inclusive el oro.
Los científicos saben que los océanos son cada vez más salados.
Por término medio, el agua de mar contiene 35 partes de minerales disueltos por cada 1.000 de agua; por este motivo es un poco más densa que el agua dulce.
Normalmente, al agua pura se le asigna una densidad de valor 1; la del agua marina común es de 1,03, por eso las embarcaciones y los nadadores flotan más fácilmente en el mar que en el agua pura.
En el Mar Muerto, en la frontera entre Jordania e Israel, el agua es tan salada y su densidad tan elevada, que no puede haber vida, de ahí su nombre.
El agua es un buen disolvente, capaz de disolver muchas materias; pero si se llena un frasco con agua de un río o de un estanque, seguramente se observarán grupos de partículas flotantes de sustancias sin disolver.
Al sumergirse éstas tan despacio, el agua las arrastra suspendidas; de ahí que el agua adquiera una tonalidad oscura, turbia.
La mayor parte de las materias disueltas en el agua son minerales; pero hay algo más, y muy importante, disuelto en prácticamente todos los tipos de agua: aire.
Gracias a él, los peces y otras formas de vida acuática pueden respirar por debajo de la superficie.
OTRAS PROPIEDADES DEL AGUA
• A una temperatura superior a los 374°C el agua es un gas perfecto: ello significa que sus moléculas se mueven con tal energía que ninguna presión puede transformaría en un líquido. Se la denomina vapor cuando puede licuarse por simple presión.
• La presión a la que se licúa el agua al llegar a los 374°C es de 274 atmósferas. Se denomina a ambas presión y temperatura críticas.
• Cuando el hielo se derrite, el agua que se forma contiene aún microscópicos cristales en solución; por eso, su viscosidad se reduce a la décima parte, entre 0° y 100°C.Pero los puentes de hidrógeno, o atracción entre las moléculas de agua, siguen actuando a elevadas temperaturas: de aquí que el punto de ebullición (cuando el agua se -transforma en vapor) y la cantidad de calor necesario para evaporar el agua, sean muy elevados.
• El agua pura es mala conductora de la electricidad.
• El vapor de agua a una densidad de 400 gr. por litro es capaz de disolver mucha sal, propiedad que se aprovecha extensamente en la industria.
• A 1,200°C de temperatura la molécula de agua se disocia casi totalmente en radicales libres (iones H+- y OH—, o sea cationes de hidrógeno y amones oxidrilo).
• Debido a que el hielo ocupa mayor espacio que el agua líquida, una presión enérgica lo licúa, lo que es fácil de demostrar apretando fuertemente el filo de un cuchillo contra un bloque de hielo.
• En condiciones de laboratorio, y a presiones superiores a 2.000 atmósferas, se eliminan los vacíos dentro de los cristales de hielo, y se obtienen cinco clases diferentes de menor volumen, que son reversibles cuando dicha presión se elimina.
• La cohesión o atracción recíproca entre las moléculas de agua es tal que para romper una columna de 1 cm². de sección se requiere una fuerza de 15.000 kg.
• Se dice que el agua moja las paredes de un tubo cuando por razones químicas o eléctricas adhiere a éste y asciende por él; debido a la cohesión entre las moléculas arrastra al conjunto de agua restante y, si el tubo es delgado, se observa un ascenso muy sensible de la columna de agua. El fenómeno se denomina capilaridad, porque se observa mejor en tubos delgados como cabellos.
• Sabemos que las bases en solución emiten iones oxhidrilos y que los ácidos emiten iones de hidrógeno; el agua es, por lo tanto, un solvente excelente de las sustancias que se disuelven en iones, que son los mismos que los que ella libera. Sin embargo, no sólo disuelve sustancias iónicas: el alcohol etílico, por ejemplo, se disuelve también en cualquier proporción.
• El peso molecular del agua es de 18: 16 por el átomo de oxígeno, y 1 por cada uno de los átomos de hidrógeno; existe un agua pesada cuyo peso molecular es igual a 20, porque consta de hidrógeno pesado o deuterio cuyo átomo tiene masa 2.
• El agua pesada es inerte; todos les animales y los vegetales morirían de sed si tuvieran que vivir de ella.
• Se observan, a veces, cañerías que se congelan a cerca de 20°C o plantas de maíz que sufren heladas arriba de los 4°C; esto se debe a la estructura particular del agua. En, efecto, si se introduce en ella minúsculas cantidades de gas metano, éste rompe las uniones entre las., moléculas, reduce la cohesión y favorece el reordenamiento en cristales de las moléculas de agua.
• El agua oxigenada H202, o peróxido de hidrógeno, es un compuesto inestable que contiene más oxígeno que el agua común y tiende a liberarlo; por eso se lo utiliza en los procedimientos de blanqueo.
• El agua tiene un color azul en espesores superiores a los 2 m.; los otros matices que presenta son debidos a impurezas o reflexión del cielo.
------------- 00000 ------------
Curiosidades Sobre el Agua

Los átomos y el agua: Es imposible imaginar el número de átomos de todo el agua de la tierra. Para hacernos una idea, diremos que en una cucharilla caben 10²³, que si se escribe con todos los ceros es 100.000.000.000.000.000.000.000 átomos.
El peso del agua: En términos exactos, un científico diría "masa" para referirse a una cantidad de agua. La masa total del agua de nuestro planeta se ha calculado en 1,3 x 10 elevado a la 18 toneladas, es decir, 18 ceros después de la coma, 1.300.000.000.000.000.000. De este total, alrededor del 97,3% es agua salada.
El mayor océano: El Océano Pacífico comprende casi la mitad del agua existente en la Tierra, con una superficie de casi 170 millones de kilómetros cuadrados, es decir, mayor que la suma de todas las tierras de nuestro planeta.
Los mayores lagos: El mayor, con gran diferencia, es el Mar Caspio, a caballo entre Ruisa y el Irán, con un área de casi 372.000 km². El mayor lago de agua dulce es el llamado Superior, situado en la frontera entre Canadá y EE.UU., cuya área es de 82.350 km². Pero el que contiene más agua, por ser más profundo, es el lago Baikal, en Siberia, Unión Soviética.
El río más largo: Se discute si es el Amazonas, el Mississippi-Missouri o el Nilo, pues los tres tienen razones para ostentar el título; pero generalmente se le concede al Nilo, en Egipto, que mide 6.670 km.
¿Dónde llueve más?: La parte más lluviosa del globo está en el norte del Golfo de Bengala, ocupando gran parte de Bangla-Desh y el Estado de Assam, en la India. La marca mundial anual y mensual la ostenta la ciudad de Cherrapunji, en Assam, que en el año que va del 31 de julio de 1860 a la misma fecha de 1861 recogió 26.461 milímetros de lluvia, es decir, la misma cantidad que cae en una población española lluviosa en 40 años. Sólo en el mes de julio de 1 861 cayeron en Cherrapunji 9.229 milímetros de agua.
El récord de precipitación en un sólo día lo tiene la isla de Reunión, en el Océano índico, al este de Madagascar, donde en un período de 24 horas se recogieron 1.870 milímetros en 1 952, es decir, el doble de la precipitación media anual en la España húmeda.
------------- 00000 ------------
Día Mundial del Agua de 2016: «El agua y el empleo».
El agua significa empleo El agua es un elemento esencial de la vida. Pero es más que esencial para calmar la sed o la protección de la salud; el agua es vital para la creación de puestos de trabajo y apoyar el desarrollo económico, social y humano.
Hoy en día, la mitad de los trabajadores del mundo (1500 millones de personas) trabajan en sectores relacionados con el agua. Por otra parte, casi todos los puestos de trabajo, con independencia del sector, dependen directamente de esta. Sin embargo, a pesar del vínculo indisoluble entre el trabajo y el agua, millones de personas cuyas vidas dependen del líquido elemento a menudo no son reconocidos o protegidos por los derechos laborales básicos. A mejor agua, mejores empleos.
------------- 00000 ------------
EL AGUA EN EL CUERPO HUMANO:
El agua es la materia más importante, sin comparación, de las que componen nuestro cuerpo y nuestra alimentación. Muchos seres vivos no son casi nada más que agua; en algunos moluscos, por ejemplo, el componente líquido llega al 99%.
Los humanos, por término medio, tienen alrededor del 65% de agua. Las personas delgadas tienen hasta el 70%; mientras que en las más gruesas, la mayor proporción de tejido graso hace que el porcentaje descienda hasta el 55%.
Entre otras funciones, el agua hace que las células (y, por tanto, toda la persona) conserven su forma y tamaño, al mismo tiempo que ayuda al aparato digestivo a abastecer nuestro organismo de las materias primas que necesita. Más del 50% de los alimentos es agua; pero el pepino por ejemplo tiene más del 90% de agua. Si no comemos y sólo bebemos agua, viviremos mucho más tiempo que si sólo ingerimos sólidos a los que se les haya extraído todo el líquido.
¡Ojalá pudiéramos ver todos los caminos por los que el agua entra en el cuerpo! Por regla general, el cuerpo necesita de tres a cuatro litros de agua al día; pero
cuando se hace un trabajo duro al aire cálido y seco, pueden hacer falta hasta 15 o 20 litros. Una parte de este total la bebemos y el resto viene con la comida.
Sudor
¿A dónde va el agua? Una cierta cantidad sale con los residuos sólidos de la digestión, pero la mayor parte se elimina por la orina. Los ejercicios vigorosos aumentan mucho la expulsión de líquido a través de la piel, es decir, el sudor. Al evaporarse el agua (y, por lo tanto, extraer el calor latente), el sudor constituye un sistema de refrigeración muy eficaz.
El aire cálido, pero seco, no es demasiado desagradable, porque promueve la evaporación rápida. Sudamos a un ritmo muy rápido, hasta dos litros por hora; pero como el líquido se evapora casi a la misma velocidad que se suda, la piel la sentimos seca. Por el contrario, el clima cálido y húmedo se hace insoportable.
El agua no puede evaporarse de prisa cuando el aire está casi saturado de humedad. El cuerpo suda, pero el sudor no se evapora al mismo tiempo, y por consiguiente nos empapamos y empapamos también la ropa. En climas cálidos necesitamos agua para sudar.
Ver: ¿Que es el poliagua?
Fuente Consultada:
Ciencia Visión AGUA Atlántida
Enciclopedia Hispanica Macropedia Tomo I
¿Sabía Ud. Que? Reader´s Digest
TECNIRAMA Enciclopedia de la Ciencia y la Tecnología
Enlace Externo:






