Espectro de la Luz:Concepto Básico y el Espectro de Emisión
Espectro de la Luz:Concepto Básico y el Espectro de Emisión en AStronomia
Cuando se impregna un hilo muy fino de platino con determinadas sales y se pone sobre la llama del mechero, dicha llama adquiere unas coloraciones que sor características del elemento metálico que forma parte de la sal.
Así, todas las sales de sodio dan coloración amarillenta, mientras que las sales de cobre proporcionan a la llama un color azul-verdoso.
También cuando hacemos pasar un rayo de luz por un prisma de vidrio podesmo descomponer a dicho rayo en varios colores, que dependerán de que material emite ese rayo de luz.
Llamamos espectro visible de emisión de un elemento, al conjunto de colores característicos que emite dicho elemento cuando se altera por el calor o por una descarga eléctrica.

Espectro de Luz Visible
La luz solar, o la emitida por un arco eléctrico, parecen blancas, pero un examen más detenido de esta luz blanca revelará que, en realidad, se compone de una mezcla de rayos de diferentes colores.
A veces, en días de sol radiante, es posible ver un espectro de luces de diferentes colores sobre la pared opuesta a una ventana.
Con cuidado, será posible ubicar la fuente de estas luces de colores y con toda seguridad se encontrará que se debe a que un rayo de luz blanca ha sido descompuesto, por refracción en algún borde de vidrio o cristal —el borde de un espejo, tal vez el de un ornamento de cristal.
Un efecto similar puede ser observado en una habitación a oscuras si se dirige un delgado haz de luz blanca hacia un prisma triangular.
Si se interpone una pantalla blanca en el camino del haz emergente, se advertirá una serie de bandas de colores.
Con un dispositivo tan rudimentario las imágenes de color se superponen.
Se puede obtener un espectro más satisfactorio de la luz blanca dirigiendo hacia el prisma un haz de rayos paralelos y enfocando los haces emergentes sobre la pantalla.
Para esto se requieren, por lo menos, dos lentes convexas.
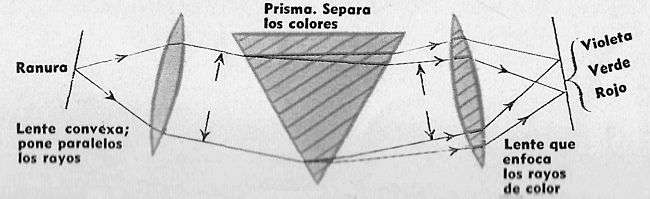
Esquema Básico de Espectrógrafo: El primer químico que hizo uso este fenómeno con fines analíticos fue el alemán. Bunsen, quien, en colaboración con Kirchhoff, ideó un dispositivo para analiza: los colores emitidos por las sales de los elementos.
Este aparato recibe el nombre de espectroscopio y consiste básicamente en un prisma en el que la luz, procedente de la llama, se dispersa.
La fuente luminosa se ubica en el foco de la primera lente, de modo que el haz de luz blanca quede compuesto de rayos paralelos.
La pantalla se ubica en el foco de la segunda lente.
Mediante este dispositivo perfeccionado, las bandas de luz de color se separan y es posible distinguir los componentes de la luz blanca: violeta, índigo, azul, verde, amarillo, anaranjado y rojo.
El prisma puede separar los componentes de la luz blanca debido a que éstos poseen distintas longitudes de onda.
De las formas visibles de movimiento ondulatorio, la luz violeta es la de menor longitud de onda y es la más desviada al pasar por el prisma.
La luz roja posee la longitud de onda mayor de todo el espectro visible y es la menos refractada (desviada).
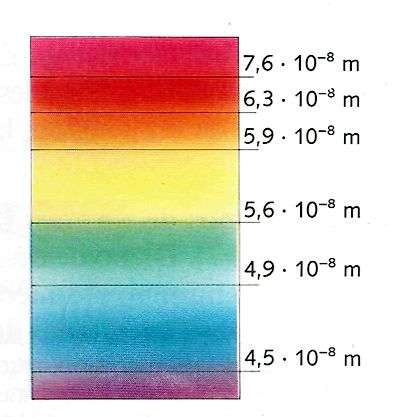
El fenómeno de descomposición de la luz en los siete colores del arco iris recibe el nombre de dispersión de la luz , y el conjunto de colores se denomina espectro visible de la luz blanca.
Cada una de las luces que componen la luz blanca recibe el nombre de luz monocromática, pues es luz que no se descompone en otras.
Bien sigamos,a hora calentando una sustancia suficientemente, lo que se pondrá en estado de incandescencia.
El color de la luz emitida es siempre característico para cada elemento presente, una especie de huella digital.
Ésta es la base del ensayo a la llama que se emplea en química analítica para identificar los constituyentes de una mezcla.
El sodio emite una luz intensamente amarilla (el color de las luces que a veces se utilizan para iluminación urbana), el potasio da un color lila y el calcio, luz color anaranjado.
También los gases dan luces de colores característicos si se los encierra en un tubo sellado a muy baja presión y se los conecta a una fuente de alta tensión.
Es conocida la luz roja emitida por el neón, que se utiliza en letreros luminosos y faros.
Las luces de color emitidas por sólidos o gases a alta temperatura pueden ser estudiadas más detenidamente por medio de un espectroscopio .
En este aparato la luz es descompuesta en sus componentes y se ve que los diferentes elementos dan espectros constituidos por series de lineas de longitud de onda característica para cada elemento.
Tan bien definidas están estas líneas espectrales que sirven para identificar elementos presentes (análisis espectral) en muestras minúsculas o para detectar impurezas infinitesimales.
En todos los casos observados, la luz procedente de la llama está formada po: un conjunto de rayas luminosas cuyo color y disposición son característicos del elemento químico de la sal que se está analizando.
Así, por ejemplo, toda.; las sales de sodio, ya sean cloruros, sulfatos, carbonatos, etc., producen dos líneas amarillas muy intensas.
Este tipo de análisis o identificación tambié" puede realizarse con elementos gaseosos encerrados en tubos de descarga eléctrica en los que se ha practicado el vacío.
Llamamos espectro visible de emisión de un elemento, al conjunto de colores característicos que emite dicho elemento cuando se altera por el calor o por una descarga eléctrica.

Ejemplo de Algunos espectros de emisión.: (Arriba) Espectro del hidrógeno. (Centro) Espectro del mercurio. (Abajo) Espectro de la luz blanca de la lámpara de arco de carbón.
En general, el espectro emitido por sustancias sólidas o líquidas en estado incandescente produce un espectro continuo.
Por el contrario, el espectro emitido por sustancias gaseosas es un espectro de rayas o discontinuo.
De igual forma que se analiza la luz o energía emitida por una sustancia, también puede analizarse la luz o energía que dicha sustancia absorbe.
Al iluminar una sustancia con un conjunto de radiaciones aparecerán en el espectroscopio todas las radiaciones, excepto las absorbidas por la sustancia en cuestión.
El espectro resultante se denomina espectro de absorción.
En el espectro de absorción aparecen rayas oscuras en las mismas zonas en que aparecían las rayas luminosas en el espectro de emisión.
Esto significa que las sustancias emiten las mismas radiaciones que absorben.
APLICACIONES DE ESTE FENÓMENO EN LA ASTRONOMIA:
La luz procedente de cada estrella es originada por incontable número de átomos; unos producen una determinada longitud de onda, y otros otra distinta.
Por consiguiente, el astrofísico necesita un instrumento capaz de descomponer la luz con exactitud en sus diferentes longitudes de onda, o sea en colores.
Una forma de conseguirlo es haciendo pasar la luz procedente de una estrella a través de un prisma de cristal.
Pero, un solo prisma separa muy poco los colores, no siendo en realidad suficiente para suministrarnos todos los resultados que necesitamos.
Debemos descomponer la luz en miles de colores o de longitudes de onda diferentes, y para conseguirlo se precisan instrumentos especiales.
Algunos de ellos, incluyendo el espectroscopio y el espectrógrafo, se describen más adelante.
Cuando la luz de una estrella incide en el ocular de un telescopio, pasa a través de una delgada rendija antes de llegar al instrumento que la descompone en los distintos colores.
Cada, color aparece como una estrecha raya, pues cada uno de ellos ha sido enmarcado por la delgada rendija.
Desde el punto de vista del astrofísico, una de las cuestiones más importantes es que para cada color en particular la raya se proyecta en un lugar determinado y no en otro cualquiera.
El conjunto completo de rayas —denominado espectro de la estrella— puede ser fotografiado y medida la posición exacta de las rayas.
De esta manera el astrofísico conoce la clase de átomos que precisamente'contiene una estrella.
Por este método ha sabido que el Sol y todas las demás estrellas que vemos brillar en el firmamento están constituidos precisamente por la misma clase de átomos que encontramos en la Tierra.
Pero el astrofísico no se conforma con saber cuáles son las diversas clases de átomos presentes en una estrella; también quiere conocer las proporciones relativas de cada sustancia.
Por ejemplo, si las rayas espectrales indican que una estrella contiene simultáneamente hidrógeno y oxígeno, quiere saber cuál es más abundante y en qué proporción.
Puede conocerlo midiendo la intensidad de las distintas rayas.
Supongamos que hay 10 veces más de hidrógeno que de oxígeno en una estrella; deberíamos esperar, por lo tanto, que llegasen más radiaciones de los átomos de hidrógeno que de los de oxígeno, lo cual se traduce en que el hidrógeno debería producir rayas más intensas que el oxigeno.
Y esto es lo que sucede en la realidad.
Así, al medir la intensidad de las rayas, el astrofísico puede deducir que el hidrógeno es 10 veces más abundante que el oxígeno, pero no puede asegurar cuántas toneladas de cada gas contiene la estrella en cuestión.
La medición de la intensidad de las rayas espectrales indica al astrónomo la composición de las capas superficiales del Sol y de otras estrellas.
Así se sabe que el Sol contiene 10 veces más hidrógeno que helio.
Los científicos saben también que estas dos sustancias son conjuntamente unas mil veces más abundantes que la totalidad de los restantes elementos.
Las capas superficiales de las estrellas varían considerablemente de unas a otras, pero en un gran número de ellas el hidrógeno y el helio son los principales constituyentes.
Fuente Consultada:
Revista N°32 TECNIRAMA Enciclopedia de la Ciencia y La Tecnologia - Los Espectros -
Secretos del Cosmos Colin A. Roman Colecciones Salvat N°2
Físico-Química Secundaria Santillana Escudero-Lauzurica-Pascual-Pastor
Temas Relacionados:
Las Franjas de Fraunhofer Concepto de Espectroscopia
Radiacion Cuerpo Negro, Explicación del Fenómeno Físico
Fuga de Galaxias Constante de Hubble Alejamiento de las Galaxias
La Astronomia en la Exploracion Espacial y el Estudio del Universo
Modelo Atómico de Bohr Niels
El Cuanto de Energia:Fisica Cuantica, La Constante de Planck
El Disco de Newton-Expliacion de La Descoposicion de la Luz
Objetivos de la Astrofísica: Historia de su Origen
Enlace Externo:• La espectroscopía en la astronomía






