Tipos de Radiaciones de un Nucleo Atomico: Alfa, Beta y Gamma
Tipos de Radiaciones de un Nucleo Atomico: Alfa, Beta y Gamma
1-Radiaciones Alfa
2-Radiaciones Beta
3-Radiaciones Gamma
 Átomo, la unidad más pequeña posible de un elemento químico.
Átomo, la unidad más pequeña posible de un elemento químico.
En la filosofía de la antigua Grecia, la palabra "átomo" se empleaba para referirse a la parte de materia más pequeño que podía concebirse.
Esa "partícula fundamental", por emplear el término moderno para ese concepto, se consideraba indestructible.
De hecho, átomo significa en griego "no divisible".
El conocimiento del tamaño y la naturaleza del átomo avanzó muy lentamente a lo largo de los siglos ya que la gente se limitaba a especular sobre él.
Con la llegada de la ciencia experimental en los siglos XVI y XVII los avances en la teoría atómica se hicieron más rápidos. Los químicos se dieron cuenta muy pronto de que todos los líquidos, gases y sólidos pueden descomponerse en sus constituyentes últimos, o elementos.
Por ejemplo, se descubrió que la sal se componía de dos elementos diferentes, el sodio y el cloro, ligados en una unión íntima conocida como compuesto químico.
El aire, en cambio, resultó ser una mezcla de los gases nitrógeno y oxígeno.
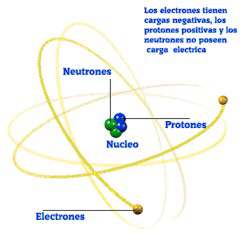
Todos sabemos que el átomo constituye una especie de sistema planetario en miniatura; el núcleo equivale al Sol, y los electrones a los planetas.
Una de las primeras preguntas que se nos pueden ocurrir a este respecto, es la siguiente: ¿cómo está hecho el núcleo, ese sol de un universo infinitamente pequeño?
Sabemos que el núcleo atómico se compone, fundamentalmente, de dos tipos de partículas materiales: los protones, cargados de electricidad positiva, y los neutrones, desprovistos de carga eléctrica.
En cambio, poco es lo que se sabe acerca de la disposición y movimiento de estas partículas.
A diferencia de lo que sucede con los electrones (los "planetas"), que giran alrededor del núcleo, no existe un modelo que ilustre de manera intuitiva cómo los protones y neutrones se mueven y disponen en el interior del mismo núcleo.
Sin embargo, los estudios y las experiencias de física nuclear han permitido obtener algunas conclusiones y datos significativos.
Por ejemplo, el núcleo del átomo del hierro, contiene 26 protones (en amarillo en la ilustración) o, lo que es lo mismo, 26 partículas provistas de una carga elemental positiva.
Estas 26 cargas positivas pueden sostener, en torno al núcleo, otras tantas cargas de signo opuesto.
Así, en el átomo neutro de hierro, 26 electrones —es decir 26 partículas provistas de una carga elemental negativa— giran alrededor del núcleo, en órbitas distintas.
Y, precisamente, es el número de protones (llamado "número atómico"), igual en el átomo neutro al número de electrones, lo que hace que el hierro sea hierro, con todas las propiedades químicas que lo distinguen.
Cada elemento químico, en consecuencia, tiene un número atómico propio.
Pero si las propiedades químicas de un átomo dependen, exclusivamente, del número atómico, otras propiedades no menos importantes dependen, además, del llamado "número de masa".
Se trata de propiedades que no pueden observarse a simple vista, pero que se revelan de modo muy espectacular en las "reacciones nucleares" (pensemos, por ejemplo, en la bomba atómica).
Ya hemos dicho que en el núcleo, además de los protones, se encuentran los neutrones, o partículas desprovistas de carga eléctrica, que pesan, aproximadamente, igual que los protones.
Pues bien: la suma del número de protones y de neutrones da el "número de masa".
Los átomos de igual número atómico, pero de distinto "número de masa", son llamados "isótopos": tienen idénticas propiedades químicas (puesto que idéntico es el número atómico), pero distintas propiedades nucleares, porque distinto es el número de masa o, lo que es lo mismo, el número de neutrones.
Tal como aparecen en la naturaleza, casi todos los elementos son mezclas de isótopos diferentes: el hierro, por ejemplo, además de átomos de 26 protones y 30 neutrones (que se hallan en franca mayoría, ya que constituyen el 91,68% de su materia), contiene también átomos de 28, 31 y 32 neutrones.
Éstos son, precisamente, los isótopos del hierro (cuyos protones continúan siendo 26), todos ellos estables, es decir, existentes en la naturaleza, sin ninguna tendencia a transformarse espontáneamente en otra cosa.
En cambio, un átomo de hierro que, junto a los 26 protones habituales tuviese en el núcleo 33 neutrones, ya no sería estable, es decir, tendería a transformarse.
Lo mismo puede decirse de los átomos de hierro con 27 ó 26 neutrones.
Se trata de un hecho muy importante, cuya significación es la siguiente: para que en un núcleo con un determinado número de protones (26 en el caso del hierro) haya estabilidad, los electrones no deben superar una cantidad determinada (28, 30, 31 y 32, en el caso del hierro).
En otras palabras: del número de neutrones depende la estabilidad del núcleo. Y ahora podemos dar otro paso y preguntarnos qué es lo que mantiene a protones y neutrones en el núcleo.
Salta a la vista que el problema es más complejo que el que presentan los electrones girando alrededor del núcleo: en este caso se trata, simplemente, de partículas cargadas negativamente (electrones), que, en virtud de las fuerzas electrostáticas, son atraídas por cargas positivas de ciertos elementos del núcleo (protones).
En el interior del núcleo, en cambio, los neutrones, desprovistos de carga, y los protones, que la tienen positiva, deberían repelerse, si sólo actuaran las fuerzas electrostáticas.
Como no sucede así, forzosamente tenemos que pensar en fuerzas de otra naturaleza; y éstas, llamadas por los científicos "fuerzas nucleares", son aún muy misteriosas.
Parece que los protones y neutrones se atraen independientemente de su carga; es decir, un protón atrae indiferentemente a otro protón, o a un neutrón, y lo mismo puede decirse de los neutrones.
En el caso, sin embargo, de dos protones, la fuerza electrostática de repulsión es más potente que la fuerza nuclear de atracción.
Debido al complejo juego de estas fuerzas, la estabilidad del núcleo depende de las relaciones entre el número de protones y de neutrones, tal como hemos explicado.
Cuando la relación protones-neutrones no asegura la estabilidad del núcleo, éste tiende a modificar la relación, emitiendo radiaciones alfa o beta, y transformándose espontáneamente en un núcleo estable.
En las radiaciones alfa, el núcleo emite las "partículas alfa", constituidas por dos protones y dos neutrones.
En las radiaciones beta, el núcleo sólo emite electrones, que no existían previamente en su interior, sino que se producen simultáneamente con la emisión, cuando un neutrón del núcleo se transforma en protón para establecer el necesario equilibrio numérico entre neutrones y protones.
------------- 00000 ------------
PARTÍCULA ALFA:
Determinadas combinaciones de protones y neutrones pueden llegar a formar un núcleo durante algún tiempo; pero el núcleo no es estable y el átomo es radiactivo. Esta clase de átomos intenta variar la proporción de protones y neutrones en el núcleo, para formar una combinación más estable, y entonces el núcleo emite una radiación. El átomo se trasforma en el átomo de un elemento distinto y se dice que se trasmutó.
 Dos protones no pueden permanecer juntos, porque ambos tienen carga positiva (cargas del mismo signo se repelen). Los núcleos que tienen protones en exceso se estabilizan por trasmutación.
Dos protones no pueden permanecer juntos, porque ambos tienen carga positiva (cargas del mismo signo se repelen). Los núcleos que tienen protones en exceso se estabilizan por trasmutación.

El núcleo de helio, con dos protones y dos neutrones, es la combinación de protones y
neutrones más estable que se conoce. Es la "partícula alfa".
Por ejemplo, si un núcleo contiene demasiados protones y neutrones para ser estable, puede expulsar algunas de estas partículas y alcanzar una mayor estabilidad.
Para ello emite dos protones y dos neutrones firmemente unidos (el núcleo, muy estable, del átomo de helio), formando una partícula única, que se conoce con el nombre de partícula alfa.
La partícula alfa lleva, por consiguiente, dos cargas positivas y tiene un peso atómico igual a cuatro, mientras que el átomo que ha emitido esta partícula alfa disminuye su número atómico en dos unidades, y su peso atómico en cuatro unidades.
Por ejemplo, los átomos de radio que se encuentran en la naturaleza (número atómico 88, peso atómico 226) emiten partículas alfa, y entonces se- trasforman en radón, un gas radiactivo (número atómico 86, peso atómico 222)
![]()
El radón mismo se trasmuta emitiendo partículas alfa. Las partículas alfa, que se emiten durante la trasmutación de los átomos, se desplazan en línea recta a través del aire, y pierden su energía a medida que van entrando en colisión con las moléculas de aire, deteniéndose, generalmente, al cabo de unos cuantos centímetros.
Todas las partículas alfa, emitidas por un isótopo determinado, suelen recorrer la misma distancia en el aire, ya que tienen la misma energía cinética, la cual van perdiendo en los choques; basta, sin embargo, interponer en su camino una hoja de papel para detener una partícula alfa.

------------- 00000 ------------
• LA PARTÍCULA BETA
Si un núcleo contiene demasiados neutrones, para ser estable puede convertir alguno de ellos en un protón. En realidad, el protón y el neutrón son partículas muy similares.
Para que un neutrón se trasforme en protón basta con que emita un electrón. El neutrón pierde, entonces, una carga negativa y se trasforma en un protón cargado positivamente:
![]()
El electrón es emitido por el núcleo con una gran velocidad; recibe el nombre de partícula beta.
El átomo conserva el mismo peso molecular después de la trasmutación, ya que la suma de protones y neutrones en el núcleo permanece constante; pero el número atómico aumenta por existir un protón suplementario.
Un ejemplo de trasmutación por emisión de partículas beta lo tenemos en el comportamiento del carbono radiactivo.
Los átomos del carbono 14 (número atómico 6, peso atómico 14), que es un radioisótopo natural del carbono 12, se trasmutan, por emisión de partículas beta, en nitrógeno 14 (número atómico 7, peso atómico 14). que tiene un núcleo estable.
Aproximadamente, la mitad de los radioisótopos naturales se puede trasmutar por emisión de partículas beta.
También muchos radioisótopos artificiales presentan una trasmutación de este tipo.
Las partículas beta son muy ligeras y se desvían muy fácilmente en su trayectoria.
Por ello, no se desplazan en línea recta como las partículas alfa. Sin embargo, suelen recorrer un espacio superior.
En el aire, una partícula beta puede alcanzar más de un metro o, incluso, atravesar una lámina de aluminio de algunos milímetros de espesor.
EL POSITRÓN
Además de las partículas alfa y beta, que emiten los radioisótopos naturales, los radioisótopos artificiales pueden emitir también una partícula, que tiene la misma masa que el electrón, pero con una carga positiva igual a la del protón.
Esta partícula se llama positrón, y puede considerarse como un electrón con una carga positiva igual, pero de signo opuesto a la del electrón.
EMISIÓN DE POSITRONES
Se ha visto que la emisión de partículas beta puede tener lugar cuando el núcleo contiene demasiados neutrones para ser estable.
Si la relación entre protones y neutrones es la correspondiente al núcleo estable, no hay radiactividad.
Si, por el contrario, el núcleo contiene demasiados protones para ser estable, puede convertir uno de sus protones en un neutrón, emitiendo un positrón que, al no poder permanecer en el núcleo, es expulsado
![]()
El átomo conserva el mismo peso atómico, pero el número atómico disminuye por haberse convertido un protón en neutrón.
En 1934, Irene Joliot-Curie formó átomos de nitrógeno 13 (número atómico 7, peso atómico 13) al bombardear boro 10 con partículas alfa.
El nitrógeno 13 se trasmutaba, por emisión de positrones, en carbono 13 (número atómico 6, peso atómico 13), y la presencia de la radiación, debida a los positrones (éstos fueron descubiertos en 1932), le permitió anunciar el descubrimiento de la radiactividad artificial:
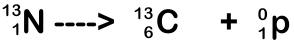
Hay, además, un tercer tipo de radiación nuclear, que siempre se presenta en compañía de una de las dos recién explicadas.
Se trata de la radiación gamma, que es de naturaleza electromagnética, como la luz y los rayos X, de los que sólo difiere por el origen (la luz y los rayos X se originan en el exterior del núcleo, como consecuencia del paso de electrones de una órbita a otra de menor energía; las radiaciones gamma, en cambio, se originan en el interior del núcleo, como consecuencia de una sucesiva estabilización de éste, sin que se modifique la relación protones-neutrones).
Las radiaciones nucleares alfa, beta y gamma constituyen, pues, el instrumento que un núcleo inestable tiene a su disposición para alcanzar la estabilidad.
En algunos elementos, tal como se encuentran en la naturaleza, la emisión de las radiaciones nucleares se verifica espontáneamente.
Se trata de los famosos elementos radiactivos, como el radio y el uranio.
Pero fenómenos de este género pueden provocarse también en el laboratorio.
Y, durante el transcurso de estas investigaciones, el hombre ha conseguido asomarse a los más profundos misterios del átomo, construir núcleos inexistentes en la naturaleza, liberar las energías encerradas dentro de los núcleos, e incluso, como veremos en otro artículo, transformar unos elementos en otros.

En 1934, Irene Joilot-Curie (hija de la famosa María Curie) y su marido, descubrieron que un isótopo estable natural (el boro 10) puede trasformarse en un elemento radiactivo distinto, por bombardeo con "partículas alfa". La radiactividad de los átomos producidos artificialmente se llama "radiactividad artificial".





