Biografia de Dalton John :Creador de la Teoria Atomica de la Materia
Biografia de Dalton John Creador de la Teoría Atómica de la Materia
Cuando John Dalton, un obsesivo célibe y devoto cuáquero, comenzó a investigar la química y las reacciones químicas, entró en la ciencia del debate feroz.
Era un debate que no se había resuelto desde los tiempos de Demócrito y Aristóteles.
¿Estaba todo hecho de elementos de construcción finitos —átomos— o era divisible infinitamente?.
Entrar en este tema era un argumento asociado con elegir definir reglas para los modos de comportamiento químicos, o sólo hacer generalizaciones sobre la naturaleza.

Hoy, está perfectamente demostrada la teoría de que la materia se halla constituida por partículas diminutas que no pueden dividirse (por procedimientos químicos) en otras más pequeñas.
Sin embargo, hace poco más de ciento cincuenta años que Dalton formuló, por primera vez, esta teoría atómica.
Filósofos de las más antiguas civilizaciones —particularmente, el pensador griego Demócrito (460-370 a C.)—, admitían que la materia estaba constituida por cierto tipo de partículas elementales o átomos.
Así, el concepto de átomo no era completamente nuevo, pero se debió a Dalton el desarrollo del mismo, definiendo más detalladamente lo que él entendía por átomo.
Dalton aclaró el camino para que los químicos que le siguieron adquiriesen una idea más clara acerca de la constitución de las sustancias y del mecanismo de las reacciones químicas.
Introdujo, en su teoría, algunas ideas importantes y nuevas.
Dijo que todos los átomos de un mismo elemento son idénticos entre sí y particularmente tienen la misma masa.
Sin embargo, los diferentes elementos tienen átomos de distinta masa, siendo, por tanto, la masa atómica una característica propia de cada elemento.
Dalton también estableció que, cuando tiene lugar una combinación química, son pequeños los números totales de átomos que se unen entre sí.
Excepto por la ligera modificación que fue necesario introducir tras el descubrimiento de los isótopos, la teoría daltoniana se acepta, hoy, en líneas generales.
Sus diversos puntos son, sin embargo, tan familiares, como las leyes químicas básicas de la conservación de la masa y proporciones múltiples.
Dalton concibió su teoría atómica durante la primera década del siglo XIX.
En aquella época, era virtualmente imposible hacer medidas precisas, puesto que los aparatos de que se disponía eran todavía demasiado primitivos.
Lo más notable de la teoría de Dalton es que ha. resistido la prueba del tiempo.
Aunque desarrolló una serie completa de experimentos para probar todas las partes de la misma, los errores experimentales introducidos fueron tan grandes, que no pudo pretender, en ningún momento, haberla probado definitivamente.
Uno de los hobbies de Dalton eran los bolos sobre hierba y creía que los átomos eran similares a bolos en miniatura. Dibujándolos como círculos se explicaba el concepto, y se cuidaba de cualquier intento de representarlos como letras.
El debate tenía un significado real. Algunas personas argumentaban que los átomos debían ser letras porque podría interpretarse como un concepto generalizado. A Dalton le gustaba su representación gráfica porque enfatizaba su teoría de que los átomos eran unidades físicas reales.
Otra importante contribución que Dalton hizo a la química fue la idea de presentar, visualmente, los compuestos químicos.
Usó un distintivo circular para representar el átomo de cada elemento (el hidrógeno era un círculo con un punto en el centro, mientras que un círculo, con una línea vertical, significaba un átomo de nitrógeno).
Dalton nació en el seno de una familia cuáquera, en Eaglesfield, pueblo del distrito de los Lagos (Inglaterra).

En 1776, cuando contaba sólo diez años de edad, entró al servicio de Elihu Robinson, un acaudalado cuáquero, que le enseñó matemáticas.
En 1781, después de una breve temporada enseñando en la escuela del pueblo, se fue con su hermano, que era profesor de una escuela de Kendal, Inglaterra.
Durante este período, inició un diario de observaciones meteorológicas, que continuó durante el resto de su vida.
También coleccionó mariposas, y reunió un gran número de plantas, formando un gran y ordenado herbario.
En 1793, se trasladó a Manchester.
Al principio, enseñó matemáticas y filosofía natural, en el New College, pero, después de seis años dimitió, y dedicó su vida a la investigación, que financiaba dando clases particulares.
Murió en 1844, habiendo hecho una de las mayores contribuciones al avance de la química teórica.
Gracias a él, una vaga hipótesis se transformó en una teoría definida.
A lo largo de su vida Dalton eligió vivir sencillamente.
Era parte de su fe cuáquera.
A su muerte, sin embargo, su capilla ardiente fue instalada en el ayuntamiento de Manchester y más de 40.000 personas le rindieron sus últimos respetos. Informes de la época cuentan que en la procesión del funeral iban 100 carruajes y tenía más de una milla de largo.
• ►Cronología de su vida
1766 Nace el 6 de septiembre
1787 Dalton comienza a complementar sus ingresos dando conferencias públicas
1792 Ambos hermanos Dalton descubren que tienen ceguera hacia los colores
1793 Se traslada a Manchester como tutor en el New College, una institución fundada por los presbiterianos. En ese momento, la educación en Oxford o Cambridge sólo era asequible para miembros de la Iglesia de Inglaterra. Publica su primer libro Observaciones y ensayos meteorológicos
1802 Dalton publica un libro en el que establece su ley de la presión parcial de los gases
1803 Dalton anuncia su ley de proporciones múltiples y publica su lista de masas atómicas y símbolos
1808 Publica Nuevo sistema de filosofía química — Parte I
1808 Publica la Parte II
1817 Llega a ser presidente de la Sociedad Filosófica, un puesto que mantiene hasta su muerte
1844 Muere de apoplejía el 27 de julio, habiendo anotado, como siempre, las condiciones meteorológicas del día en su diario.
LA TEORÍA DE DALTON APLICADA A LOS GASES:
Los gases ideales están formados por diminutas partículas, que denominamos "moléculas".
Estas moléculas se mueven con libertad, chocando unas contra otras, y contra las paredes del recipiente que las contiene.
El choque es "perfectamente elástico".
Si dejamos caer una pelota al suelo, el choque es "perfectamente elástico" cuando, al rebotar, ésta alcanza la altura inicial.
Si el choque es "parcialmente elástico", la altura alcanzada en cada bote sucesivo irá disminuyendo y, finalmente, la pelota quedara parada sobre el suelo.
Las moléculas de los gases ideales no se paran nunca, porque sus choques son "perfectamente elásticos".
Su velocidad depende de la temperatura, y, si ésta no cambia, la velocidad media de las moléculas permanece constante.
La presión ejercida sobre las paredes del recipiente que contiene un gas se debe al "bombardeo molecular".
Si no existiera ninguna molécula en el interior del recipiente o su velocidad fuese nula (cero absoluto de temperatura) la presión sería también nula.
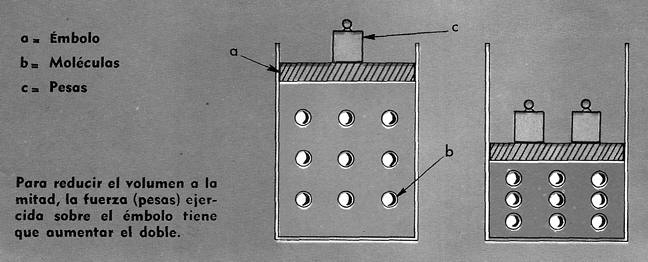
Si consideramos un cierto número de moléculas de un gas en un recipiente cilíndrico cerrado por un embolo (ver esquema), debemos aplicar cierta fuerza para equilibrar los choques de las moléculas sobre él.
Pero si reducimos el volumen a la mitad, bajando el émbolo, el número de choques, a la misma temperatura, aumentará al doble, y, por tanto, la fuerza que deberemos aplicar al émbolo se duplicará.
La presión es la fuerza aplicada por unidad de superficie (en nuestro caso, del émbolo).
Por lo tanto, al reducir el volumen a la mitad, la presión aumenta al doble, y el "producto de la presión por el volumen permanece constante". Ésta es la ley que Boyle encontró experimentalmente.
Pero, para que el razonamiento anterior sea correcto, se precisa una nueva condición: las diversas moléculas que componen el gas no deben atraerse o repelerse entre sí, es decir, no pueden existir "fuerzas intermoleculares".
Supongamos que las moléculas presentan una cierta fuerza de atracción.
Esta fuerza varía con la distancia.
Cuando dos moléculas se encuentran a distancias muy grandes, su valor es despreciable, pero, a medida que se aproximan, su valor crece con rapidez.
El efecto de esta fuerza es "juntar" las moléculas, o sea, es necesario aplicar menos fuerza sobre el émbolo para mantenerlas en un volumen determinado.
Al disminuir el volumen, el valor de estas fuerzas crece y, por tanto, no se precisa aplicar al émbolo una fuerza que sea "exactamente" el doble, para reducir el volumen a la mitad.
Éste es el caso en los gases reales.
En los gases ideales, se supone que estas fuerzas no existen, por lo que sólo estos gases cumplen la ley de Boyle con exactitud.
SÍNTESIS DE LA TEORÍA ATÓMICA DE DALTON
Con lo que hemos estudiado hasta el momento somos capaces de decidir si una sustancia es un elemento químico, un compuesto químico o una mezcla.
También podemos calcular la cantidad de reactivos que necesitamos combinar para obtener una cierta cantidad de producto.
Sin embargo, todavía no disponemos de una teoría que sea capaz de explicar todos estos conocimientos.
Esta teoría, conocida como teoría atómica, fue enunciada, en los primeros años del siglo XIX, por el químico inglés John Dalton, aunque sería modificada posteriormente gracias a las aportaciones del químico italiano Amadeo Avogadro.
Sus ideas principales se pueden resumir de la siguiente manera:
a) La materia es discontinua. Es decir, los cuerpos están formados por partículas independientes llamadas átomos.
b) Existen distintos tipos de átomos. Un elemento químico es una sustancia formada por un solo tipo de átomos. Los átomos de un determinado elemento químico son iguales entre sí. pero son distintos de los átomos de los restantes elementos.
c) Una molécula es la parte más pequeña de una sustancia pura capaz de existencia individual estable.
Unas moléculas se diferencian de otras por el número y tipo de los átomos que las forman, así como por la manera en la que dichos átomos están colocados.
Una sustancia pura es una sustancia formada por un solo tipo de moléculas.
Dicho de otro modo, las moléculas de una sustancia pura son iguales entre sí. pero son distintas de las moléculas de las restantes sustancias puras.
d) Las moléculas pueden estar formadas por un solo átomo (moléculas monoatómicas), pero lo más frecuente es que estén formadas por dos o más átomos, que pueden ser del mismo o de distinto tipo.
Si las moléculas de una sustancia pura son monoatómicas o contienen átomos del mismo tipo, la sustancia es un elemento químico; en caso contrario, la sustancia es un compuesto.
Un compuesto químico es una sustancia pura cuyas moléculas están formadas por dos o más tipos de átomos.
------------- 00000 ------------
Daltonismo:
Se dice que cierto físico inglés dibujaba un prado, y la hierba la pintaba de color rojo. Le llamaron la atención diciéndole que aquél era el color de la sangre, a lo que contestó:
«Pero ¿no es lo mismo?» Éste físico se llamaba John Dalton y había nacido el 5 de septiembre de 1766 en Eaglesfield, en el Cumberland. Profesor de historia natural y de matemáticas, descubrió leyes importantes sobre la dilatación de los fluidos y la de las mezclas de gases, y definió la noción de molécula y de peso molecular.
Se dio cuenta —o lograron que se diera cuenta— de que los colores de determinadas flores —rojo, anaranjado, amarillo y verde— eran para él de un solo tono amarillento.
Sus palabras exactas fueron: «Una mancha de tinta ordinaria en un papel blanco tiene para mi el mismo color que una persona sana.
La sangre se parece al verde oscuro de las botellas.»
Por ello se llama daltonismo a la enfermedad de la vista que hace confundir unos colores con otros.
En atención a quienes padecen dicha anomalía, en algunos países los semáforos tienen la luz roja circular y la verde, cuadrada. Recuerdo haber visto esas señales de tráfico en Zurich.
Fuente Consultada:
Revista TECNIRAMA N°67
FÍSICA II Polimodal
CONSULTORA Enciclopedia Temática Ilustrada Tomo 10 El Mundo Físico
Historia de las Ciencias Desiderio Papp





