Resumen de la Teoria Atomica Historia y Fundamentos de la Física
Resumen de la Teoría Atómica
Historia y Fundamentos de la Física Atómica
¿Que es un átomo? - La Energía Nuclear - La Física Moderna - La Fisión Nuclear - Partículas Elementales -
• Los Fundamentos de la Física Atómica:
Paralelamente a otros importantes adelantos (que aqui hemos hablado), otras líneas de investigación estaban socavando una de las premisas básicas de la física del siglo XIX, según la cual los átomos, las unidades fundamentales de la materia, eran indivisibles e indestructibles.
Desde mediados de siglo, el uso del espectroscopio (instrumento para analizar las longitudes de onda de la luz) estaba cada vez más difundido en la investigación química.
Para examinar la luz emitida por los gases, una de las prácticas más corrientes consistía en mantenerlos a baja presión y hacer pasar una descarga eléctrica por su interior.
 En el curso de uno de estos experimentos, en 1895, el físico alemán Wilhelm Roentgen descubrió por azar los rayos X.
En el curso de uno de estos experimentos, en 1895, el físico alemán Wilhelm Roentgen descubrió por azar los rayos X.
Estos rayos tenían una singular capacidad de penetración (que enseguida encontró aplicación práctica en el diagnóstico médico y, más adelante, en el tratamiento de ciertas enfermedades), por lo que Roentgen llegó a la conclusión de que debían ser ondas electromagnéticas de longitud muy corta.
Su investigación le valió el premio Nobel en 1901, el primer año en que se concedieron estos premios.
Los experimentos de Roentgen sobre la descargas eléctricas en gases a baja presión estaban inspirados en los realizados por William Crookes en Gran Bretaña y en los de sus compatriotas J. Plücker y J.W. Hittorf.
En 1879, Crookes había descrito con todo detalle las propiedades de lo que denominó «rayos moleculares», demostrando que proyectaban sombras, que calentaban los objetos que tocaban y que eran desviados por un campo magnético.
Sospechando que no estaba ante alguna forma de radiación electromagnética, sino ante una corriente de partículas, Crookes describió el fenómeno observado en sus tubos de descarga como «materia radiante».
Sus trabajos ampliaron las investigaciones anteriores de Hittorf y Plücker, quienes habían demostrado que estos tubos podían emitir dos tipos de radiación, según la naturaleza de la descarga eléctrica: un resplandor con un espectro continuo de longitudes de onda o bien una emisión compuesta por unos pocos máximos espectrales.
Con la perspectiva que da el tiempo, los resultados obtenidos por estos precursores (que despertaron gran interés en su época) resultan poco concluyentes, ya que no ofrecían posibilidades de interpretación específica.
Sin embargo, abrieron a la investigación un campo nuevo y enormemente fructífero y concentraron la atención en esta rama de la física.
Los nuevos Rayos X suscitaron gran interés.
Dos de sus investigadores fueron J.J. Thomson, que desde 1884 ocupaba la cátedra Cavendish de la Universidad de Cambridge, y uno de sus estudiantes, el neozelandés Ernest Rutherford.
Las investigaciones sugirieron que los rayos X no eran productos primarios, ya que los generaban los rayos catódicos, así llamados porque eran emitidos por el cátodo (electrodo negativo) de un tubo gaseoso de descarga.
En 1897, Thomson estableció que los rayos catódicos no eran una variedad de radiación electromagnética (se desplazaban 1.600 veces más lentamente que la luz), sino una corriente de partículas con carga negativa.
Consiguió entonces medir el coeficiente de la carga sobre la masa de las partículas individuales y poco después logró medir la carga, lo cual le permitió calcular la masa.
El resultado fue asombroso.
La partícula, que pronto recibiría el nombre de electrón, tenía una masa 1.800 veces más pequeña que la del átomo más ligero (el de hidrógeno).
Claramente, los átomos no eran, después de todo, las partículas más pequeñas en la naturaleza.
Mientras tanto, otros importantes descubrimientos se estaban realizando en Francia.
En 1896, el físico Henri Becquerel descubrió que el metal uranio emitía una radiación penetrante, capaz de impresionar una placa fotográfica.
Por su parte, dos colegas de Becquerel en París, el matrimonio Marie y Fierre Curie, se preguntaron si no habría otras sustancias dotadas de similares propiedades «radiactivas» y, tras una serie de experimentos extremadamente laboriosos, consiguieron aislar pequeñas cantidades de dos elementos especialmente activos, el polonio (bautizado en honor al país de origen de Marie) y el radio.
Inmediatamente, Rutherford se concentró en el estudio de la radiactividad y en poco tiempo descubrió que había dos tipos de emisiones, a las que denominó rayos alfa y beta.
Más adelante, en el curso de sus investigaciones en la Universidad McGill de Canadá, estableció que los átomos de donde procedían esos rayos se desintegraban espontáneamente.
Tras su regreso a Inglaterra (Manchester), en 1908, demostró que las partículas alfa eran en realidad átomos de helio con carga positiva.
El mismo año 1908, el físico alemán H.W. Geiger (famoso por el contador de partículas) y E. Marsden, en colaboración con Rutherford, comprobaron que cuando una corriente de partículas alfa cae sobre una lámina de oro, la mayoría la atraviesan, pero unas pocas (alrededor de 1 en 8.000) experimentan una importante desviación.
Rutherford llegó a la conclusión de que la carga positiva en los átomos de oro debía estar concentrada en una pequeña región en el centro de cada átomo.
Sobre esta base, Rutherford formuló su teoría sobre la estructura del átomo: un núcleo relativamente pequeño con carga positiva, donde se concentra la mayor parte de la masa, rodeado de una nube de electrones cuya carga negativa vuelve al átomo eléctricamente neutro.
El problema de la estabilidad de esta estructura y las razones por las que no sufre un colapso sobre sí misma fueron explicados en 1912 por el físico danés Niels Bohr, que aplicando la base de la teoría cuántica enunciada anteriormente, en 1905, por el físico alemán Max Planck, perfeccionó la representación gráfica del átomo de Rutherford.

De esta forma, los fundamentos de la física atómica quedaron firmemente establecidos por estos destacados científicos.

Dos de los grandes pioneros de la física atómica, Rutherford (a la derecha) y H.W. Geiger, colaboraron en Gran Bretaña, en la Universidad de Manchester, en 1907-1912. Con E. Marsden, desarrollaron la teoría nuclear del átomo. Geiger es recordado por ser el inventor del contador que lleva su nombre y que sirve para medir las partículas alfa.
NUEVA TEORÍA SOBRE EL ÁTOMO:
La teoría cuántica sobre la estructura de los átomos, publicada en 1913 por Niels Bohr, cambió la concepción científica del mundo invisible de las partículas atómicas.
Antes de la impactante propuesta de Bohr, su mentor, Ernest Rutherford, había sostenido que la estructura del átomo consistía en un núcleo con carga positiva rodeado de una nube de electrones más pequeños con carga negativa, que describían órbitas en torno al núcleo como los planetas rodean a una estrella.
Sin embargo, si se aplicaran las leyes de la física a este modelo, el átomo se desestabilizaría y se descompondría.
Basándose en las ideas de Max Plank y de Albert Einstein, Bohr afirmó que un átomo en su estado estable no emite energía (en forma de fotones, unidades minúsculas de luz).
Según él, solo emite energía (o la absorbe) en pequeños grupos llamados «cuantos» cuando un electrón salta bruscamente de una órbita a otra.
Además, un átomo cuenta con un número limitado de órbitas de electrones y precisamente este número determina su potencial para combinarse con otros átomos.
Empleando la constante de Planck (el número invariable que Planck descubrió para cuantificar la relación entre la energía y la materia), Bohr hizo una descripción puramente matemática del comportamiento de los electrones.
Así, definió la naturaleza del átomo.

Cuando otros científicos, entre ellos Einstein, confirmaron la teoría de Bohr con mediciones espectroscópicas, se reconoció como un gran avance.
Bohr recibió el Premio Nobel en 1922 por su descubrimiento y, durante los años 20, su Instituto de Física Teórica en Copenhague se convirtió en un centro internacional de investigación.
Robert Oppenheimer, famoso en los años 40 como director del equipo que fabricó la primera bomba atómica, recordó: «Fue una época heroica. Supuso la colaboración de muchos científicos de países muy distintos.
El espíritu crítico, sutil y profundamente creativo de Niels Bohr guió, moderó, profundizó y transformó definitivamente la iniciativa de todos ellos».
Bohr, un hombre notablemente modesto, filósofo y científico, continuó con el desarrollo de su principio de correspondencia, que relaciona sin ruptura los conceptos de la física clásica (que aplicó al mundo visible) con los del mundo abstracto de la teoría cuántica.
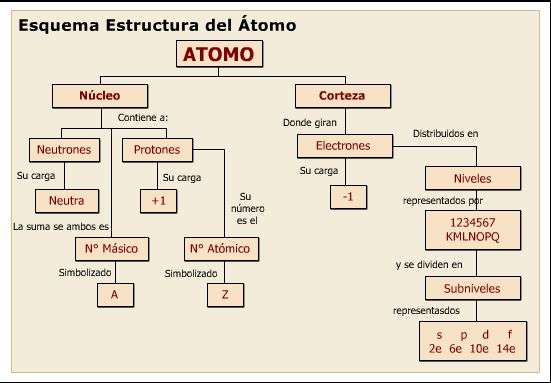
Esquema estructura del atomo
Fuente Consultada:
El Estallido Cientifico en el Siglo XX Trevor Williams
El Gran Libro del Siglo XX Clarín
Enlace Externo Relacionado: El Mundo Atomico





