Caracteristicas del Agua Potable y las Condiciones Para Su Consumo
Caracteristicas del Agua Potable y las Condiciones Para Su Consumo-Proceso de Potabilización y Purificación
Es el compuesto químico más abundante pues cubre el 73% de la superficie de la Tierra, y tiene gran importancia en el desarrollo de nuestra vida.
La mayoría de reacciones químicas que tienen lugar en los organismos vivos, en la Naturaleza en general, y las que se llevan a cabo en el laboratorio y en la industria se realizan entre substancias disueltas en agua; de aquí su enorme importancia desde el punto de vista químico.

Un agua para ser potable debe reunir las condiciones siguientes:
1) Ser incolora, inodora, límpida y de sabor agradable.
2) Debe ser aireada, es decir, contener aire disuelto, de modo que no resulte indigesta.
3) Sólo debe contener trazas de materia orgánica disuelta, pero sin amoníaco presente, pues éste indicaría el contacto con materia orgánica en putrefacción.
4) No debe contener más de 1,5 g de sales totales disueltas por litro.
5) No debe tener una dureza mayor de 250 p.p.m. (partes por millón) expresada en carbonato de calcio.
Las aguas duras tienen entre otras propiedades el ser indigestas, cortar el jabón y cocer mal las legumbres.
6) No debe contener nitritos y la cantidad de nitratos debe ser muy pequeña.
7) No debe contener gérmenes productores de enfermedades.
8) Las aguas corrientes de abastecimiento público no deben contener más de 0,2 p.p.m. de cloro activo o residual. Este cloro residual proviene del cloro o de las cloraminas empleadas como bactericidas.
------------- 00000 ------------
CONTENIDO MEDIO DE AGUA EN EL CUERPO

En el cuerpo humano el contenido de agua varía según los órganos, tejidos y líquidos. He aquí algunas cifras que ¡lustran al respecto: Sudor: 99,5 por ciento; líquido cefalorraquídeo: 99: linfa: 96; riñon: 83; tejido conjuntivo: 80; pulmones: 79; piel: 72; médula y encéfalo: 70; esqueleto: 22; esmalte dentario: 0,2.
------------ 00000 ------------
Características del Agua
El agua es un compuesto de hidrógeno y oxígeno, en la proporción de dos volúmenes de hidrógeno por uno de oxígeno.
En peso, estos elementos se hallan en la relación de 1 gramo de hidrógeno por 8 gramos de oxígeno.
Esto puede probarse por análisis (descomponiéndola por electrólisis) o por síntesis, mezclando volúmenes adecuados de hidrógeno y de oxigeno, produciendo una explosión y comprobando que dan agua.
El agua en la Naturaleza no suele ser pura pues contiene sólidos, líquidos y gases en disolución o en suspensión.
Para obtener agua químicamente pura hay que someterla a una destilación o tratarla con resinas intercambiadores de iones.
Estas resinas se dividen en catiónicas, que absorben iones positivos, cediendo iones hidrógeno, y en amónicas que se combinan con los ácidos originados por las resinas catiónicas.
A temperatura ordinaria el agua es un líquido inodoro, incoloro e insípido, si bien en grandes masas presenta color azulado.
Se toma como substancia de referencia en la determinación de los puntos fijos del termómetro, fijándose la temperatura de o° para la fusión del agua y la de 100° para la de su ebullición, en la escala centígrada o de Celsius.
También se utiliza el agua para definir la unidad de calor. Una caloría es la cantidad de calor necesario para elevar un grado centígrado la temperatura de 1 gramo de agua.
La densidad de una substancia es su peso por unidad de volumen.
El agua tiene su mayor densidad a la temperatura de 4 °C pues entonces un centímetro cúbico pesa 1 gramo.
En consecuencia, por encima y por debajo de esta temperatura su volumen aumenta, y por ello el hielo flota sobre el agua (densidad del hielo 0,9167 g/cm3).
El agua al solidificarse se dilata y ejerce elevadísimas presiones y de aquí el peligro de rotura de las conducciones de agua frente a una eventual congelación en invierno.
Esto también ocurre al introducirse por los intersticios de las rocas y al congelarse llega a romperlas y desmenuzarlas.
En presencia de agua se realizan gran número de reacciones químicas, sobre todo las relacionadas con la vida animal y vegetal.
En consecuencia, un procedimiento de conservación de frutas y carnes consiste en desecarlas y así se evita su descomposición, porque sin el agua que contienen no es posible la fermentación ni la putrefacción.
Algunas veces el agua actúa favoreciendo reacciones químicas, como en el ataque de los metales por el oxígeno del aire auxiliado por la presencia del agua.
Algunos metales, como el litio, el sodio y el potasio, descomponen el agua a la temperatura ordinaria.
Otros, como el magnesio y el calcio lo hacen a la temperatura de ebullición, mientras el hierro y el carbón al rojo lo hacen en estado de vapor, obteniéndose el óxido correspondiente e hidrógeno.
Precisamente éste es un procedimiento industrial de obtención de hidrógeno.
El agua se une a muchas substancias, especialmente sales, dando hidratos.
Por ejemplo, se asocia al sulfato de cobre, de color blanco, en número de 5 moléculas de agua por cada molécula de sulfato y da lugar a unos cristales de color azul muy vistosos (S04Cu-5H20).
Este sulfato se denomina hidratado para diferenciarlo del blanco, que se llama anhidro.
Los óxidos reaccionan con el agua formando ácidos y bases, según se trate de un óxido de no metal o de un óxido metálico, respectivamente.
El proceso que tiene lugar cuando el agua reacciona con una substancia dando una reacción de doble descomposición se conoce como hidrólisis.
Supongamos que hemos disuelto cloruro de bismuto en agua. Se produce una disolución de iones, según esta fórmula:
Cl2Bi + 3H2O ----> 3 ClH + Bi (OH)2
Existirán los iones: Cl- , H+ , Bi+ , OH-
Por tratarse de un ácido fuerte, el clorhídrico (ClH), predominarán los iones H+ sobre los oxidrilos OH- y la hidrolización, el líquido, tendrá carácter ácido.
Si se tratara de una disociación con ácido débil y base fuerte, la hidrólisis tendría carácter alcalino.
El agua ocupa la mayor parte de la superficie de nuestro planeta.
Y según afirman los científicos, en ella se inició la vida hace millones de años.
Se trata de una sustancia excepcional, porque naturalmente se encuentra en las tres fases: sólida, líquida y gaseosa.
En este sentido, si se compara la molécula de agua con otras similares, parecería que su fase dominante es la gaseosa en lugar de la líquida. Sin embargo, esta última es la que se presenta en el rango de temperatura que existe en una gran mayoría de la superficie del planeta. Esto se debe a la formación de dipolos.
• AGUA DESTILADA.
Es el agua químicamente pura.
La que se utiliza en las grandes ciudades es agua potable, pero no destilada.
El agua de lluvia y la de nieve suele ser muy pura, pero así y- todo lleva substancias en disolución y en suspensión.
Para conseguir H2O puro no queda otro remedio que someter el agua corriente a un proceso denominado destilación.
Consiste en hervirla y convertirla en vapor. Este vapor se recoge cuidadosamente y al pasar por un refrigerador se enfría y se convierte de nuevo en líquido, pero esta vez en agua pura y destilada.
Este proceso se realiza en un aparato llamado alambique que consta de una caldera o recipiente para hervir el agua, y un serpentín para recoger el vapor y licuarlo.
AGUA NATURAL Y SU DEPURACIÓN.
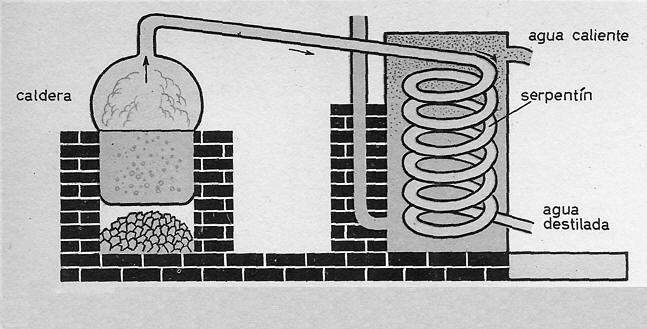
El agua natural más pura es la procedente de la lluvia.
La de los ríos contiene mayor número de impurezas y su contenido varía según la situación de los mismos y recorrido.
Le sigue el agua de mar, siendo el agua de los lagos y de los mares interiores la que acumula mayor número de impurezas.
El agua se denomina dura cuando se resiste a formar espuma al ser agitada con disolución de jabón.
Ello se debe a que contiene cantidades apreciables de sales cálcicas y magnésicas.
Estas aguas no son aptas para la bebida o para usos culinarios, ni tampoco pueden utilizarse para fines industriales, pues forman incrustaciones en las tuberías y calderas.

Cuando la dureza es debida a bicarbonatos de calcio o de magnesio se habla de dureza temporal, porque puede eliminarse por simple ebullición, pues en esta operación el bicarbonato se transforma en carbonato que precipita.
La dureza debida a sales solubles de calcio o magnesio que no pueden eliminarse por ebullición se denomina dureza permanente.
Aquéllas suelen desaparecer adicionando carbonato sódico al agua.
También se utilizan unos productos llamados zeolitas, que tienen la propiedad de intercambiar los iones responsables de la dureza por iones sodio.
Un pedazo de zeolita en un litro de agua de mar la convierte en una hora en agua potable.
El agua destinada al uso doméstico se denomina agua potable. Contiene pequeñas cantidades de sales cálcicas y magnésicas, su sabor es agradable, cuece bien las legumbres, forma espuma persistente con el jabón, y no debe contener gérmenes nocivos para la salud.
Para eliminar las bacterias y microbios patógenos, se somete el agua a sucesivas filtraciones y se la trata con productos químicos (ozono o cloro) de acción microbicida.
EJEMPLO REAL DE POTABILIZAR AGUA
(Gentileza Aguas Argentinas)
El agua potable resulta un recurso indispensable para la vida humana. La planta Libertador General San Martín, ubicada en la ciudad de Buenos Aires, suministra 3.000.000 de m3 de agua potable por día.
ETAPAS DE POTABILIZACIÓN DEL AGUA |
|
|
El agua es captada del Río de la Plata a 1.700 m de la costa. |
|
|
Electro bombas elevan el agua a cámaras ubicadas a 10 m de altura sobre el nivel del río. Desde allí el agua recorreré toda la planta cayendo por gravedad hacia los distintos procesos que la transformarán en agua potable. |
|
|
Para coagular -flocular- las partículas de arcilla del agua se utiliza Al2(S04)3-sulfato de aluminio-que se genera in situ mediante el agregado de Al(OH)3 (hidróxido de aluminio) y H2S04. El floculo de sulfato de aluminio y arcilla es separado en decantadores gigantescos. |
|
|
Se inyecta lechada de cal -Ca(OH)2 o hidróxido de calcio-, para neutralizar parcialmente el exceso de ácido sulfúrico. |
|
|
El agua pasa por lechos filtrantes de arena; cuando sale ya es transparente. Se agrega más cal para completar la neutralización. |
|
|
Se agrega cloro gaseoso para eliminar microorganismos, queda una concentración residual de cloro de 0,5 ppm disuelta en el agua para evitar posteriores contaminaciones. |
|
|
Se toma una muestra de agua cada 8 minutos (5.400 al mes). Se controlan 70 parámetros químicos y bacteriológicos. Hay sensores automáticos en cada salida de planta que permite un monitoreo constante. El agua se distribuye hacia toda la ciudad de Buenos Aires y a numerosos partidos del conurbano bonaerense. |
|
• PROPIEDADES FÍSICAS DEL AGUA:
Muchas propiedades físicas del agua tienen importantes implicancias desde el punto de vista geológico, meteorológico y biológico.
Por ejemplo:
• Calor específico.
Con un valor de 4.185 joule/g °C el agua es la mayor de todas las sustancias sólidas y líquidas, a excepción del litio, del hidrógeno y del amoníaco licuado.
Su elevada capacidad para almacenar calor hace que los océanos puedan regular la temperatura terrestre y tener un papel estabilizador en las variaciones de temperatura de la atmósfera, eliminando los fríos y los calores extremos y permitiendo la existencia de las especies vivas muy sensibles.
• Calor latente de fusión.
Su valor de 79 Kcal./l es el mayor, exceptuando el del amoníaco.
Esto permite un efecto de termostato en las proximidades del punto de fusión, lo que se relaciona con la interacción entre la criosfera y la hidrosfera, en relación con los fenómenos de erosión.
• Calor latente de evaporación.
Es de 547 Kcal./l a 100 °C y representa el mayor valor conocido. Resulta relevante en la transferencia de calor y de vapor de agua a la atmósfera.
• Densidad.
Para el agua pura es máxima a 4 °C y una atmósfera de presión, exactamente 1 g/cm3. Al aumentar la salinidad, las temperaturas a las que corresponde la máxima densidad son menores.
Como ya mencionamos en el capítulo 3, esta propiedad es importante para lograr una distribución vertical de las temperaturas de mares y lagos y en los procesos de mezcla.
• Tensión superficial.
Esta magnitud a 20 °C alcanza un valor de 72,76 dyn/cm. Es el valor máximo de todos los líquidos a esa temperatura, y tiene importancia en fenómenos de superficie y en la formado: de gotas.
La tensión superficial explica fenómenos biológicos tales como el movimiento de las chinches de agua en la superficie del agua.
• Constante dieléctrica.
A 20 °C y una atmósfera; alcanza un valor de 80,36. Es la mayor en líquidos ; tiene especial interés para facilitar la disociación de moléculas inorgánicas.
Por ejemplo, para mantener la presión osmótica y el equilibrio ácido-base de la célula, son importantes las sales disociadas e: aniones (Cl-) y cationes (Na+, Mg++). La retención de iones produce un aumento en la presión osmótica y por lo tanto, la entrada de agua a la célula.
• Viscosidad dinámica.
Tiene un valor relativamente alto, ele 0,01 g/cm3 a 20 °C y una atmósfera, aproximadamente cien veces mayor que el aire.
Como consecuencia, el agua es un medio que ofrece resistencia a los organismos que deben desplazarse en ella, pero a su vez facilita la suspensión de las comunidades planctónicas.
• Poder disolvente de las sales y del oxígeno.
El agua es la sustancia que más solutos, gases, líquido; y sólidos es capaz de disolver y además de hacerle en mayor proporción, por lo que nunca se encuentren estado puro en la naturaleza.
Incluso el agua de lluvia, que es la de más baja contaminación de otras sustancias, contiene gases y un 0,003% de minerales disueltos, como calcio, magnesio y sodio.
Así como la solubilidad de las sales aumenta, en general, al aumentar la temperatura, ocurre lo contrario con los gases.
A medida que disminuye la temperatura, la solubilidad del gas aumenta (tengan en cuenta al respecto, los postulados de la teoría cinética.
Mientras que se disuelven 370 g de cloruro de soda (NaCl) en un litro de agua a 20 °C, a la misma temperatura se disuelven 9 mg de oxígeno en un litro de agua.
La situación se modifica si la presión aumenta, ya que la solubilidad del gas aumenta.
Así, la trucha y el salmón no pueden vivir en agua, cuy: temperatura es mayor a 15 °C.
Si bien el oxígeno se forma en el agua a partir de la fotosíntesis producida por las algas verdes, la mayor concentrado: proviene de la disolución del oxígeno contenido en la atmósfera, disolución que es favorecida por el movimiento de las aguas.
Los peces y otros anímales acuáticos, así como las bacterias aeróbicas, necesitan del oxígeno para vivir, ya que lo utilizan para respirar.
Las bacterias aeróbicas (descomponedoras) transforman la materia orgánica disuelta en el agua en materia inorgánica y dióxido de carbono (CO ).
Cuando la concentración de materia orgánica es alta, la demanda de oxígeno por parte de las bacterias pone en riesgo la vida en el bioma acuático.
Para que un pez pueda vivir, necesita aproximadamente 4 mg de oxígeno por litro de agua; si las bacterias hacen disminuir esta concentración, el pez muere por asfixia (o anoxia).
Tal vez por muchas de las razones enumeradas, el agua es el compuesto químico más abundante en los seres vivos y el principal componente del citoplasma celular.
Por otra parte, ningún ser vivo puede sobrevivir sin agua, y cada uno tiene su modo particular de obtenerla y aprovecharla.
El organismo humano está constituido sobre todo por agua, y su contenido se encuentra en relación con la edad y con la actividad metabólica de ese organismo; en el embrión es mayor (90-95%) y disminuye progresivamente en el adulto (entre 60% y 70%).
Las dos partes del peso del hombre y de la mujer consisten en agua.
El cerebro, por otra parte, está constituido por un 99% de agua, mientras que el esqueleto, por un 44%.
La necesidad diaria de agua de un adulto es entre 2,5 y 2,7 litros.
La función de agua en el cuerpo humano es mantener la disolución de las enzimas y el resto de sustancias orgánicas de la célula.
Participa en el proceso digestivo v en el mantenimiento de la temperatura corporal.
Transporta los nutrientes en la sangre y ayuda a eliminar los desechos metabólicos.
El agua que ingresa al cuerpo en general proviene del exterior (agua exógena) o del interior (agua endógena), y esta última se obtiene, fundamentalmente, mediante el metabolismo celular.
A su vez, el organismo pierde agua "obligatoriamente" a través de la transpiración, de la orina y de las lágrimas.
El agua resulta tan importante que nuestro organismo es incapaz de soportar una pérdida de agua del 20% .
¿Por qué?.
Sin ella no hay orina, por lo tanto, tampoco eliminación de los productos tóxicos del metabolismo y, en el caso de las aves, de los mamíferos y del ser dimano, resulta una sustancia necesaria para mantener constante la temperatura corporal.
De ello deriva la necesidad de beber por lo menos 2 litros de líquido diarios, ya sea en forma de caldo, jugo, infusión, bebidas gaseosas, gelatina o agua.
La cantidad de agua en el cuerpo humano y en otros organismos, así como la concentración y distribución de iones, deben mantenerse constantes, al igual que la temperatura y los niveles de glucosa.
El mecanismo que controla la homeostasis de los líquidos y los iones en el cuerpo se denomina osmorregulación.
Una reflexión final: la Organización de las Naciones Unidas para la Infancia (UNICEF) considera que cada eco mueren unos quince millones de niños por la escasez y la mala calidad del agua.
Tema: Condiciones Para Que El Agua Sea Potable
Fuentes Consultadas:
QUÍMICA I Polimodal Alegría-Bosack-Dal Fávero-Franco-Jaul-Rossi
CONSULTORA Tomo 10 El Agua y sus propiedades
Temas Relacionados
• Condiciones Para Que El Agua Sea Potable Características
• Efemerides Del Agua-Los Cientificos Que Investigaron El Agua
• Acuifero Guarani y la Lucha Por el Agua
• Curiosidades Sobre El Agua y Propiedades
• Porque se Dilata el Agua al Congelarse?
Enlace Externo:• El Mejor Invento de la Historia












