La Electrolisis del Agua-La Descomposición en Oxigeno e Hidrogeno
Electrólisis:Descomposición Del Agua en Oxígeno e Hidrógeno
LA ELECTRÓLISIS DEL AGUA: El agua (H2O) tiene una molécula que se compone de dos átomos de hidrógeno y un átomo de oxígeno.
Por tanto, no es de extrañar que se haya pensado en utilizarla como materia prima para la obtención de alguno de los dos elementos, especialmente teniendo en cuenta su abundancia, ya que constituye casi el 7 % de la masa de la Tierra.
Normalmente, el agua se utiliza para obtener hidrógeno, ya que el oxígeno se puede producir más económicamente por otros medios (por ejemplo, licuando el aire y destilándolo a continuación).
Entre los diversos métodos con que hoy cuenta la química para descomponer el agua se halla la electrólisis, procedimiento que implica la utilización de energía eléctrica y que, por tanto, no es de los más económicos.
No obstante, al obtenerse simultáneamente oxígeno como subproducto, el método no resulta, en realidad, tan costoso, y mucho menos para aquellos países, como los escandinavos, que disponen de energía eléctrica a bajo precio.
A primera vista, se diría que el agua no se puede descomponer por electrólisis, pues para que se verifique el transporte de electrones en el seno de un líquido es necesario que éste contenga iones, (átomos o grupos atómicos con carga), y el agua no los contiene.
Esto último no es rigurosamente cierto, puesto que el agua, aunque poco, está ionizada, según la siguiente reacción:
H2O <===> H+ + OH—
Es decir, parcialmente se encuentra en forma de iones hidrógeno (H+) e iones oxidrilo (OH—).
Pero, además, este fenómeno (la ionización del agua) se acentúa agregándole ciertos reactivos que, en teoría, pueden ser: una sal, un ácido o un álcali (base).
En la práctica, la utilización de sales presenta el inconveniente de que se producen reacciones que atacan los electrodos, por lo cual habría que utilizar electrodos inertes, de grafito o de platino.
Si se utilizan ácidos (sulfúrico o clorhídrico) sucede algo análogo, ya que la descarga de los aniones correspondientes (S04=,Cl-) es de gran actividad.
Por último, la utilización dé bases, como la soda (Na OH) o el carbonato sódico (CO3 Na2), casi no presenta inconvenientes y, por ello, es la que se practica.
Puesto que hay que partir del punto de que la energía eléctrica es costosa, se precisa estudiar minuciosamente el método, o lo que es lo mismo, el diseño de la cuba electrolítica o célula, para obtener rendimiento máximo con mínima energía.
La potencia de cualquier aparato eléctrico y, por tanto, la de la cuba, se obtiene mediante la siguiente expresión (Ley de Joule):
W= I x V
en donde I es la intensidad de corriente y V, el voltaje.
La intensidad de la corriente en amperios necesaria para producir una determinada cantidad de hidrógeno se sabe con facilidad, teniendo en cuenta las leyes de la electrólisis, de Faraday (96.500 culombios depositan un equivalente gramo de cualquier sustancio), y que 1 amperio= 1 culombio/segundo
Por un razonamiento sencillo se desegundo, mostraría que,durante una horc, 1.000 amperios pueden liberar cerca de medio metro cúbico de hidrógeno.
En cuanto al voltaje de la corriente, interviene una serie de factores, que son los que, en realidad, determinan ios características a las que se ha de ajustar la célula electrolítica.
Se ha comprobado experimentalmente que el voltaje necesario se compone de tres factores, o sea:
V=V1+V2 + V3
V1 es el voltaje necesario para descomponer el agua;
V2 es la sobretensión de los electrodos, y
V3 es la caída óhmica a lo largo de la cuba electrolítica.
Para obtener el mínimo consumo de electricidad (o sea, la potencia, en vatios, mínima) en la liberación del hidrogene es evidente que, siendo fija la intensidad de la corriente, hay que disminuir lo más posible el voltaje (V).
Pero V1 es una cantidad constante y, por tanto, no se puede actuar sobre ella. Quedan así por examinar V2 y V3.
En la sobretensión (V2) influyen los siguientes factores: la naturaleza de los electrodos (los que producen mencr sobretensión son los de níquel y hierro), la temperatura del baño, la viscosidad del electrolito, la densidad de le corriente que atraviesa el baño, etc.
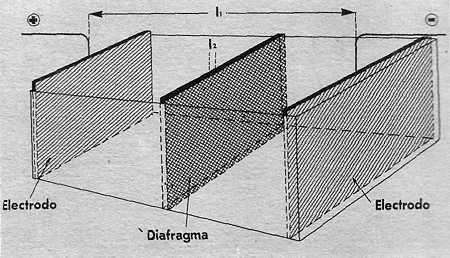
En la caída óhmica (V3), y teniendo en cuenta que hay que introducir en la cuba unos diafragmas para evitar que se mezclen el hidrógeno y el oxígeno producidos , influyen la longitud de la cuba (l1), el coeficiente de resistividad del electrodo, el espesor del diafragma (l2), el coeficiente de resistividad de éste, la resistividad del electrolito, etc.
Del estudio de las variables anteriores se deduciría que le célula electrolítica ideal debería tener unos electrodos en forma de láminas muy grandes —para que admitan muchos amperios—, colocados bastante próximos, para que li fuera mínima; entre ellos se colocaría el diafragma c película metálica de pequeño espesor —para que l¡¡ sea mínimo— y con unos orificios de diámetro suficiente, para no ofrecer resistencia al paso de los iones.
En la práctica, existe una serie de células que presente diversas ventajas e inconvenientes, como resultado de haberse tenido en cuenta, en mayor o menor grado, las variables que intervienen en el proceso, algunas de las cuales no se pueden armonizar.
Una de las más utilizadas es la "Schmidt-Oerlikon" que trabaja a 2,3 voltios y consume 6 kwh por cada metro cúbico de hidrógeno liberado (simultáneamente se libere 0,5 m3 de oxígeno).






