Cantidad de Calor:Concepto de Caloria, Equivalente Mecanico de Joule
CONCEPTO DE CANTIDAD DE CALOR, CALORÍA, EQUILIBRIO TÉRMICO Y EL EQUIVALENTE MECÁNICO
Temas Tratados:
1-Introducción Elemental
2-Temperatura y Cantidad de Calor - Ejemplos-
3-La Caloría-Definición
4-Calor Específico
5-Tabla de Calores Específicos
6-Ejemplos Simples
7-Equivalente Mecánico del Calor
8-Medición del Calor Específico
• ►INTRODUCCIÓN HISTÓRICA ELEMENTAL:
Cuando dos sistemas a diferentes temperaturas se ponen en contacto, la temperatura final que alcanzan ambos sistemas tiene un cierto valor comprendido entre las dos temperaturas iniciales.
Esta es una observación común.
El hombre ha tratado desde hace mucho de encontrar una interpretación a fondo de tales fenómenos.
Hasta principios del siglo XIX, se explicaban estos fenómenos admitiendo que en todos los cuerpos existía una sustancia material, llamada calórico.
Se creía que un cuerpo a elevada temperatura contenía más calórico que otro a baja temperatura.
Cuando los dos cuerpos se ponían en contacto, el cuerpo rico en calórico comunicaba algo de esa sustancia al otro, hasta que ambos cuerpos alcanzaban la misma temperatura.
La teoría del calórico podía describir muchos procesos, tales como la conducción del calor o la mezcla de sustancias en un calorímetro, de una manera satisfactoria.
Sin embargo, el concepto de calor como sustancia, cuya cantidad total permanecía constante, a la larga no pudo resistir la prueba de los experimentos.
No obstante, todavía describimos muchos cambios de temperatura comunes como el paso de "algo" de un cuerpo que está a mayor temperatura al que se encuentra a menor temperatura, y a este "algo" le llamamos calor.
Una definición útil pero no operacional, es la siguiente:
Calor es aquello que se comunica entre un sistema y su medio ambiente como resultado únicamente de la diferencia de temperaturas
A la larga se llegó a entender que el calor es una forma de la energía y no una sustancia.
La primera prueba conclúyeme de que el calor no podía ser una sustancia fue dada por Benjamín Thompson (1753-1814), un norteamericano que más tarde llegó a ser Conde Rumford de Baviera.
En una memoria presentada ante la Royal Society en 1798 escribió:
Yo...estoy persuadido, de que el hábito de conservar los ojos abiertos a todo lo que ocurre en el curso ordinario de las cosas de la vida ha conducido, como si fuera por accidente, o en las excursiones juguetonas de la imaginación
...a dudas útiles y a esquemas valiosos de investigación y mejora, más a menudo que las más intensas meditaciones de los filósofos, en las horas que expresamente se dedican al estudio.
Fue por accidente que me vi conducido a hacer los experimentos de los cuales voy a dar cuenta.
Rumford hizo su descubrimiento mientras estaba supervisando la perforación de cañones para el gobierno bávaro.
Para impedir que se sobrecalentara, el alma del cañón se conservaba llena de agua.
El agua se reponía conforme se iba evaporando durante el proceso de taladrado.
Se aceptaba que era calórico lo que tenía que proporcionarse al agua para ponerla a hervir.
La producción continua de calórico se explicaba admitiendo que cuando una sustancia se subdividía en partículas más y más finas, que es lo que ocurre al taladrar, su capacidad para retener calórico se hacía cada vez más escasa, y que era el calórico desprendido de esta manera lo que motivaba que el agua hirviera.
Sin embargo, Rumford observó en experimentos específicos, que el agua hervía aun cuando los útiles para taladrar quedaban tan embotados que ya no cortaban ni subdividían la materia.
Escribió después de eliminar por los experimentos todas las interpretaciones posibles del calórico:
...al razonar sobre este asunto, no debemos olvidar el tener en consideración esta circunstancia tan notable, que la fuente de calor generado por rozamiento, en estos experimentos, parecía evidentemente ser inagotable... me parece extremadamente difícil, si no totalmente imposible, formarse una idea clara de alguna cosa capaz de ser excitada y comunicada en la forma como el calor era excitado y comunicado en estos experimentos, como no sea el MOVIMIENTO.
Aquí tenemos el germen de la idea de que el trabajo mecánico gastado en el proceso de taladrado era el responsable de la creación del calor.
La idea no fue claramente expresada, sino hasta mucho tiempo después, por otros investigadores.
En lugar de la continua desaparición de energía mecánica y la continua creación de calor, no obedeciendo ninguna a ningún principio de conservación, se vio entonces todo el proceso como una transformación de energía de una forma en otra, conservándose la energía total.
Aun cuando el concepto de energía y de su conservación parece autoevidente hoy en día, era una idea novedosa todavía en los años de 1850 y había escapado a mentes tales como las de Galileo y Newton.
En la historia subsecuente de la física, esta idea de conservación condujo a los hombres a nuevos descubrimientos. os primeros pasos de su historia fueron notables por muchos conceptos.
Diversos pensadores llegaron a este gran concepto aproximadamente al mismo tiempo; al principio, todos ellos o fueron recibidos fríamente o no se les hizo caso.
El principio de la conservación de la energía fue establecido independientemente por Julius von Mayer (1814-1878) en Alemania, James Joule (1818-1889) en Inglaterra, Hermann von Helmholtz (1821-1894) en Alemania, y L. A. Colding (1815-1888) en Dinamarca.
Fue Joule quien demostró experimentalmente que al convertir una cantidad dada de energía mecánica en calor, siempre se produce la misma cantidad de calor.
Así fue definitivamente establecida la equivalencia del calor y la energía mecánica como dos formas de energía.
Helmholtz fue quien primero expresó claramente la idea de que no sólo el calor y la energía mecánica son equivalentes sino que todas las formas de energía lo son, y que no puede desaparecer una cantidad dada de una forma de energía sin que aparezca una cantidad igual en alguna de las otras formas.

Rumford, un norteamericano, fue el fundador de la Royal Institucion de Londres.Por otra parte, la Smithsonian Institution en Washington debe su origen a un inglés.
Temperatura y cantidad de calor. Su diferenciación mediante ejemplos:
Para calentar 10 Kg. de agua desde 20°C hasta 100°C, por ejemplo, hace falta quemar una cantidad mayor de gas que para calentar 2kg de agua entre las mismas temperaturas.
Si se dispone del mismo "fuego" en ambos casos, el calentamiento de los 10 Kg. requerirá más tiempo durante el cual, claro está, se consumirá mayor cantidad de gas.
También se puede utilizar un mechero que consuma mayor cantidad de gas en la unidad de tiempo.
Si tenemos un fósforo encendido, podemos con él producir la ignición de un papel. Con 5 Kg. de agua a 50°C podemos calentar en unos cuantos grados una pieza de cobre de 10 Kg.
Pero no podemos con ella encender un trozo de papel ni con el fósforo calentar apreciablemente la masa de cobre.
Observaciones de este tipo han llevado a la conclusión de que en los fenómenos térmicos la temperatura desempeña un papel importante; pero hay algo más que no puede ser caracterizado por ella.
Esta conclusión unida a otras ha llevado a admitir que, cuando un cuerpo dado se enfría, pierde (entrega o cede) una cantidad de calor y que cuando se calienta, recibe (absorbe o toma) una cantidad de calor.
Por razones que no es del caso exponer aquí, ha sido necesario admitir que la cantidad de calor que intercambia un cuerpo cuando su temperatura varía, es proporcional a la masa del cuerpo y a la diferencia entre las temperaturas final e inicial del calentamiento o enfriamiento.
La constante de proporcionalidad depende del material que forma el cuerpo, como veremos enseguida.
Si un cuerpo (o varios) se enfría (o enfrían) en contacto con otro (u otros) que se calienta (o calientan) y no se produce cambio alguno en el estado de los cuerpos ni otras transformaciones, fuera de los calentamientos y enfriamientos, la cantidad de calor que pierden los cuerpos que se enfrían es igual a la cantidad de calor que reciben los cuerpos que se calientan.
Todo sucede como si la cantidad de calor intercambiada saliese de los cuerpos que se enfrían y pasase íntegramente a los cuerpos que se calientan.
¿Qué es el calor?
A nivel microscópico, como ya lo hemos explicamos cuando hablamos de temperatura, todas las moléculas de un sistema físico se encuentran en continuo movimiento; en el caso de los sólidos se trata de una vibración en torno a una posición de equilibrio y en el de los gases es un movimiento aleatorio.
Este movimiento de las partículas tiene asociada una energía cinética, que debe clasificarse en dos tipos diferentes: la correspondiente al movimiento del sistema en su conjunto y la que corresponde al movimiento de unas partículas con respecto a otras.
La suma de las energías cinéticas de todas las partículas de un cuerpo es llamada energía interna o térmica, y su aumento o disminución lo apreciaremos a través de la temperatura.
El calor es una forma de energía, y la energía calórica de un cuerpo es la suma de las energías cinéticas de sus moléculas.
Esta interpretación permite formarnos una imagen clara de lo que ocurre cuando ponemos en contacto dos cuerpos con diferentes temperaturas: pasa energía de las moléculas de uno a las del otro, mediante la interacción de choques o de atracciones, hasta que las energías cinéticas medias se igualan (o sea, se igualan las temperaturas).
Así se comprende que los gases de la llama de un fósforo tengan temperatura mayor que una olla de agua caliente, pero menor cantidad de calor, o sea, menor cantidad de energía.
• ►Cantidad de Calor : La Caloría
La unidad de cantidad de calor Q se define cuantitativamente en función de un cierto cambio producido en un cuerpo durante un proceso especificado.
Así, si se eleva la temperatura de un kilogramo de agua de 14.5 a 15.5°C calentándolo, decimos que se ha agregado al sistema una kilocaloría (Kcal.).
La caloría (= 10-3 Kcal.) se usa también como unidad de calor.
(La "caloría" que se usa para medir el contenido de energía de los alimentos es en realidad una kilocaloría.)
En el sistema inglés de unidades de ingeniería la unidad de cantidad de calor es la British thermal unit (Btu), que se define como la cantidad de calor necesaria para elevar la temperatura de una libra de agua de 63 a 64°F.
Las temperaturas de referencia se estipulan porque, en la vecindad de la temperatura ambiente, hay pequeñas variaciones en la cantidad de calor necesaria para producir una elevación de un grado según sea el intervalo de temperatura escogido.
No tomaremos en cuenta esta variación para la mayoría de los fines prácticos. Las unidades de cantidad de calor están relacionadas como sigue:
1.000 Kcal. = 1.000 cal = 3.968 Btu = 4184 joules.
En base a la definición anterior si tenemos una masa de agua de 450 g de la cual sabemos que se calienta de 15°C a 30°C.
Por cada gramo y por cada grado centígrado, esa masa de agua toma una caloría.
Como las cantidades de calor son proporcionales a la masa de los cuerpos que se calienta y a la diferencia de temperatura (final menos inicial), en el ejemplo dado el agua habrá tomado 1 cal g-1 C-1 x 450 g x (30 —15) °C = 675 cal.
(Hacemos notar que el cal es el símbolo de caloría.)
Si la misma masa de agua se hubiese enfriado de 30°C a 15°C hubiese cedido esa misma cantidad de calor.
El resultado del cálculo sería -675 cal, pues la diferencia entre paréntesis hubiese sido (15—30).
Si el calentamiento del agua se hubiese producido en contacto con un cuerpo de masa m cuya temperatura hubiese variado entre ti y 30° (la temperatura final es la misma, ya que suponemos que el agua y el cuerpo llegan a un equilibrio térmico), el cuerpo en cuestión hubiese cedido al agua (él hubiese perdido, entregado) una cantidad de calor dada por la expresión de proporcionalidad:
Q - c . m . (ti-30)
Q es el símbolo general para cantidades de calor.
Ahora bien, la masa de agua es el único cuerpo que se calentó y la cantidad de calor calculada para el calentamiento del agua es la misma que entregó el cuerpo al enfriarse.
Por esta causa dijimos que estábamos en presencia de una manera de medir cantidades de calor.
La constante de proporcionalidad, c, que aparece en la última fórmula no es otra cosa que el calor específico del cuerpo o material de que se trate.
Su definición es la cantidad de calor necesaria para aumentar en 1°C la temperatura de 1 g del material que forma el cuerpo.
Si comparamos esta definición con la de caloría, veremos que el calor específico del agua es 1 cal/g (grado ºC).
El calor específico de una sustancia, ce, es la cantidad de calor necesaria para elevar un grado la temperatura de un kilogramo de dicha sustancia. Se mide en J/(kg . K) en el SI.
También se puede expresar en cal/(Kg . °C).
La cantidad de calor necesaria para que una masa m de una sustancia aumente su temperatura desde T1, hasta T2 se expresa entonces así:
Q = m . ce . (T2 — T1) = m. ce. ▲T
(▲T): se lee delta T , es la variación de la temperatura, y equivale a la temperatura final menos la temperatura inicial.
|
TABLA DE CALORES ESPECÍFICOS |
||
| Sustancia | c.e. (Cal./Kg./°C) | c.e. (J./Kg./°K) |
| Aluminio | 210 | 878 |
| Cobre | 90 | 375 |
| Hierro | 110 | 460 |
| Plomo | 30 | 125 |
| Mercurio | 30 | 125 |
| Plata | 60 | 250 |
| Latón | 90 | 375 |
| Vidrio | 160 | 667 |
| Arena | 200 | 835 |
| Hielo | 500 | 120 |
| Agua Pura | 1000 | 4180 |
| Agua de Mar | 940 | 3900 |
| Alcohol Etílico | 550 | 2400 |
| Glicerina | 580 | 2420 |
| Trementina | 420 | 1750 |
| Aceite | 400 | 1670 |
| Vapor de Agua | 460 | 1920 |
| Carbono | 121 | 500 |
| Wolframio | 32 | 135 |
Para pasar de (cal./Kg./°C) a Kcal. se multiplica por 1000. Lo mismo si se quiere pasar de Kg. a gr. se divide por 1000. También de Cal. a Joule (J.) divide por 0,24. Si divide para el aluminio los 210 por 0,24
se obtiene en Joule, 878.
EJEMPLOS:
• ¿Que cantidad de calor se necesita para elevar la temperatura de 50 gr. de cobre desde 18°C. hasta 98°C?
El aumento de temperatura delta T es: ▲T=98-18 = 80°C
El calor específico del cobre es de 0,09 cal./gr./° C.
La masa m = 50 gr., el calor específico s = 0,09 = 9:100 cal./gr./° C, la variación de temperatura es = 80° C.
La cantidad de calor es Q = m x s x t = 50 x 9:100 x 80 = 360 calorías.
De la definición de caloría (cantidad de calor que se necesita para elevar la temperatura de 1 g. de agua en 1° C), se deduce que el calor específico del agua es de 1,00 cal./gr.° C.
Éste es el mayor calor específico de todas las sustancias ordinarias.
Es, por ejemplo, unas 5 veces mayor que el calor específico de la arena.
Para producir el mismo aumento de temperatura, el agua absorbe una cantidad de calor 5 veces mayor que una masa igual de arena.
Esto explica por qué el mar tarda más en calentarse, durante el día, que una playa de arena; y por qué la arena de la playa se enfría más rápidamente al llegar la noche.
Otro Ejemplo:
• ¿Cuánto calor es necesario para aumentar en 25 °C la temperatura de 3 Kg. de agua?
Suponemos que no hay cambios de estado:
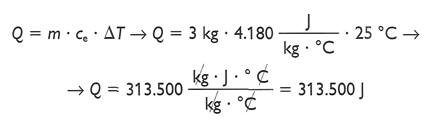
La cantidad de calor pedida depende únicamente de la masa y del aumento de temperatura, para el caso del agua.
• Introducimos una barra de aluminio, de 0,2 Kg., a 80 °C en un vaso con 0,25 Kg. de agua a 20 °C. Calcular la temperatura final, suponiendo que no hay pérdidas de calor con el ambiente.
Cuando se alcance el equilibrio térmico ambos estarán a la misma temperatura.
El aluminio cede calor (Qc) y disminuye su temperatura:
![]()
El agua absorbe calor (Qa) y aumenta su temperatura:
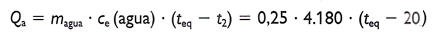
Si no hay pérdidas de calor se cumple que: el calor cedido (negativo) por la barra de aluminio es igual al absorbido (positivo) por el agua.
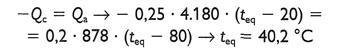
Un bloque de cobre de 75 g, se saca de un horno, y se echa en un depósito de vidrio de 300 g que contiene 200 g de agua.
La temperatura del agua se eleva de 12 a 27°C. ¿Cuál era la temperatura del horno?
Este es un ejemplo de dos sistemas que se encontraban originalmente a diferentes temperaturas y que alcanzaron el equilibrio térmico después de ponerse en contacto.
No interviene energía mecánica, sólo hay un intercambio de energía calorífica.
Por consiguiente:
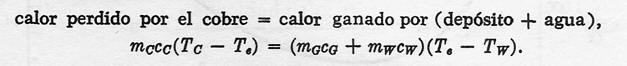
El subíndice C representa al cobre, G al vidrio y W al agua.
La temperatura inicial del cobre es Tc, la temperatura inicial del agua del depósito es Tw, y la temperatura final de equilibrio es Te.
Sustituyendo los valores dados, con Cc=0.093 cal/g C, Cg = 0.12 cal/g C°, y Cw = 1.0 cal/g C°, obtenemos:
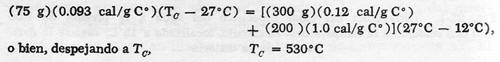
Equivalente Mecánico del Calor
Si el calor no es sino otra forma de la energía, cualquier unidad de energía puede ser una unidad de calor.
La caloría y el Btu se originaron antes de que fuera aceptado generalmente que el calor es energía.
Fue Joule quien primero midió cuidadosamente el equivalente en energía mecánica de la energía calorífica, esto es, el número de joules equivalente a 1 caloría, o el número de pies-libras equivalente a 1 Btu.
El tamaño relativo de las "unidades caloríficas" y de las "unidades mecánicas" se puede encontrar efectuando experimentos en los cuales una cierta cantidad medida de energía mecánica se convierte completamente en una cantidad medida de calor.
Joule usó originalmente un aparato en el cual unas pesas que caían hacían girar un conjunto de aspas en un recipiente con agua
La pérdida de energía mecánica se calculaba conociendo los pesos y las alturas
Esquema del Calorímetro de Joule
Aparato de Joule para medir el equivalente mecánico del calor.
Las pesas que caen hacen girar las aspas que agitan el agua en el recipiente, elevándole su temperatura
de las cuales caían y la ganancia de energía calorífica, determinando el equivalente en agua del conjunto y su elevación de temperatura. Joule deseaba demostrar que se obtendría la misma cantidad de energía calorífica al consumir una cierta cantidad dada de trabajo independientemente del método seguido para producir el trabajo.
 Producía calor agitando mercurio; frotando entre sí anillos de hierro en un baño de mercurio; convirtiendo energía eléctrica en calor en un alambre sumergido en agua; y de otras formas. Siempre coincidía la constante de proporcionalidad entre la cantidad de calor producido y la cantidad de trabajo ejecutado dentro de su error experimental de 5%.
Producía calor agitando mercurio; frotando entre sí anillos de hierro en un baño de mercurio; convirtiendo energía eléctrica en calor en un alambre sumergido en agua; y de otras formas. Siempre coincidía la constante de proporcionalidad entre la cantidad de calor producido y la cantidad de trabajo ejecutado dentro de su error experimental de 5%.
Joule no disponía de los termómetros exactamente comparados que tenemos en la actualidad, ni podía hacer correcciones tan seguras de las pérdidas de calor del sistema como es posible hacerlo ahora.
Sus experimentos originales son notables no sólo por la habilidad e ingenio que mostró sino también por la influencia que tuvieron para convencer a los hombres de ciencia de todas partes, de lo correcto del concepto de que el calor es una forma de la energía.
Los resultados aceptados son:
1 kcal = 1 000 cal = 4 186 joules,
1 Btu = 252.0 cal = 777.9 pies Ib;
esto es, cuando se convierten en calor 4.184 joules de energía mecánica, elevan la temperatura de 1 Kg. de agua de 14.5 a 15.5°C.
En calorimetría moderna las cantidades de calor se miden casi siempre la función de la energía eléctrica proporcionada a un baño de agua al hacer pasar una corriente por una resistencia que se encuentra dentro del baño; raras veces se miden observando la elevación de temperatura de un baño de agua.
Así pues, la unidad práctica lógica de calor es el joule (1 joule = 1watt-seg) y de hecho es la que se adoptó como unidad internacional aceptada jara el calor por la Novena Conferencia General de Pesas y Medidas (1948).
De hecho, en la práctica moderna de los laboratorios, la caloría (o la kilocaloría) si se usa mucho ni se necesita.
Sin embargo, está profundamente metida en la literatura científica.
Para permitir el seguir usando esta unidad familiar —-pero para reconocer la importancia práctica del joule— a menudo se define una nueva kilocaloría, la kilocaloría termoquímica:
1 Kilocaloría=4184.0 joules (exactamente)
Medida del color específico del aluminio, por el método de las mezclas.
El aluminio se calienta en agua hirviendo, y luego se sumerge en el agua fría del calorímetro.
El calor ganado por el agua fría y el calorímetro puede calcularse, y es igual a Q, el calor cedido por la masa m de aluminio.
El calor específico s del aluminio puede deducirse de la ecuación:
Q= m . s . ▲T
(observación: en este ejemplo s=ce el calor específico del material)
MEDIDA DEL CALOR ESPECÍFICO DE UN SÓLIDO
Este experimento ofrece un ejemplo del llamado "método de las mezclas". Está basado en el hecho de que el calor que pierde un cuerpo caliente lo gana un cuerpo más frío.
El experimento será correcto si se toman las precauciones necesarias para que no haya pérdidas de calor fuera del aparato.
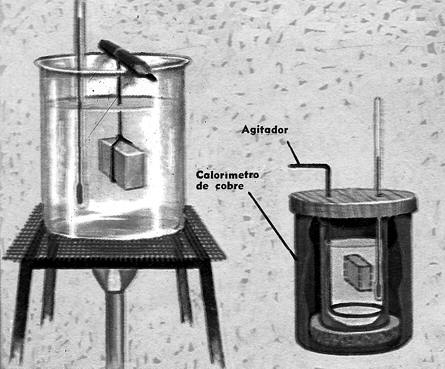
La parte principal del aparato es el "calorímetro", un recipiente de cobre con paredes de poco grosor (el cobre tiene un bajo calor específico y, por lo tanto, una pequeña capacidad para absorber calor) que debe estar muy bien pulido, para evitar las pérdidas de calor por radiación.
El calorímetro se coloca sobre un soporte de corcho (un mal conductor del calor), en el interior de un recipiente mayor, que sirve de protección contra los cambios en la temperatura exterior.
Normalmente, el calorímetro se cierra con una tapadera que lleva un termómetro, esencial para todos los experimentos de medidas de calor.
A través de la tapadera pasa también una varilla de cobre, con la que puede removerse el contenido del calorímetro.
Supongamos que queremos calcular el calor específico del aluminio por el método de las mezclas.
Se pesa la muestra de aluminio, así como el calorímetro vacío con su agitador.
Luego se llena el calorímetro con agua hasta la mitad, y se pesa de nuevo, para calcular la masa de agua que contiene, por la diferencia entre las dos pesadas.
El aluminio se calienta, sumergiéndolo en un vaso con agua en ebullición.
La temperatura del agua hirviendo será la temperatura inicial del aluminio.
Mientras se calienta el aluminio, se mide la temperatura del agua fría en el calorímetro.
Luego, el aluminio caliente se transfiere muy rápidamente al calorímetro (procurando no llevar agua caliente con él).
El agua del calorímetro se agita, para igualar la temperatura del agua, y se anota la temperatura más alfa que alcance el termómetro.
Antes de averiguar el calor específico (s) del aluminio, hay que realizar las siguientes medidas.
Con ellas, y el calor específico del cobre y del agua, que son factores conocidos, no necesitamos más datos.
Masa del aluminio = 10 gr.
Masa del calorímetro vacío = 50 gr.
Masa del agua en el calorímetro = 80 gr.
Temperatura Inicial del aluminio = 99,5° C.
Temperatura inicial del calorímetro = 17,5° C.
Temperatura final del aluminio y del calorímetro = 19,5° C.
Calor específico del cobre = 0,09 cal./gr./° C.
Calor específico del agua = 1 cal./gr./° C.
Utilizando estos datos, se hacen los siguientes cálculos:
Disminución de temperatura de los 10 gr. de aluminio = 99,5—19,5 = 80°C.
Por tanto, el calor perdido por el aluminio es:
Q= m .c. ▲T = 10 . s . 80 = 800 x s calorías.
Elevación de temperatura del calorímetro de cobre = 19,5 - 17,5 = 2°C.
Por lo tanto, la cantidad de calor Q ganada por el calorímetro es:
Q=m. s. ▲T=50 . 0,09 x 2 = 9 calorías.
Como la elevación de temperatura del agua del calorímetro es también 19,5— 17,5 = 2°C, la cantidad de calor ganada por 80 gr. de agua es:
Q=m. s. ▲T = 80 . 1 . 2 = 160 calorías.
Así, la cantidad total de calor ganada por el agua y el calorímetro es de 160 + 9 = 169 calorías.
Ahora bien, las 800 x s calorías perdidas por el aluminio son iguales a las 169 cal. que ganan el agua y el calorímetro.
Luego 800 x s = 169.
Dividiendo ambos miembros de la ecuación por 800, tenemos:
Calor específico del aluminio s = 169/800 = 0,21 cal./gr./° C
Fuente Consultada:
Revista TECNIRAMA N° 54
FÍSICA I RESNIK-HOLLIDAY
Elementos de Física y Química Maiztegui-Sabato
Enciclopedia del Estudiante Tomo 7 Físico-Química
Temas Relacionados:
Primeros Descubrimientos Sobre el Calor Historia de los Estudios
Calor Producido Por la Corriente Electrica Aplicaciones
Thompson, Conde de Rumford Vida y Obra Científica Sobre el Calor
Los Termometros:Principio de Funcionamiento, Tipos y Errores
La Dilatacion Termica de los Materiales
Uso de las Fuerzas Naturales:Aplicaciones del Viento, Calor y Agua
Enlace Externo: Primer Principio de la Termodinámica





