Explicación de la Tabla Periodica de los Elementos Quimicos: Facil y Simple
Explicación de la Tabla Periódica de los Elementos Químicos: Tabla de Mendeleiev
El estudio del átomo llevó a establecer algunas propiedades de los elementos químicos, que al ser comparadas con las de otros elementos, observaban similitudes, ofreciendo posibilidad de clasificación.
• ►Explicación Simple y Práctica de la Tabla
Haz Clic Para Ver La tabla Grande
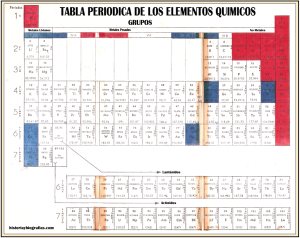
Para entender la explicación de la organización de los elementos quimicos debes ampliar la tabla de arriba
El átomo de hidrógeno (número atómico = 1) posee un electrón de corteza girando alrededor del núcleo.
Todos los demás son múltiplos de esta unidad atómica; sólo se diferencian en el número de electrones que giran alrededor del núcleo y en el número de partículas que constituyen el núcleo.
El número atómico expresa la cantidad de electrones que posee la corteza del átomo del elemento correspondiente.
La masa atómica (calculada en base a carbono = 12) (número que figura en la parte inferior de cada rectángulo) es ei valor promedio entre las masas atómicas de los diversos isótopos de un mismo elemento.
Las masas atómicas que figuran entre paréntesis expresan el número de masa del isótopo más estable o más común del respectivo elemento.
Los rectángulos de cada'columna vertical o grupo contienen alineados verticalmente los átomos de igual comportamiento.
El número romano que encabeza cada columna expresa el número de electrones que posee la órbita más externa u órbita de valencia, que en ningún caso es superior a ocho.
Los grupos I, II y III (marcados en azul) incluyen los átomos electropositivos (que engendran bases).
Los grupos V, VI y VII (marcados en rojo) incluyen los átomos electronegativos (que engendran ácidos).
El número de fila o serie de ordenamiento horizontal se denomina período. Dicho número indica el número de órbitas, las cuales se designan con las letras K, L, M, N, O, p y Q.
Cada serle indica un piso electrónico más que el anterior.
Calor específico es el calor necesario para elevar en un grado centígrado la temperatura de un gramo de átomo.
Potencial normal de un elemento es el que éste toma cuando está en contacto con una solución normal de sus iones a 25° C y presión normal (760 mm).
Haz Clic Para Ver La tabla Grande
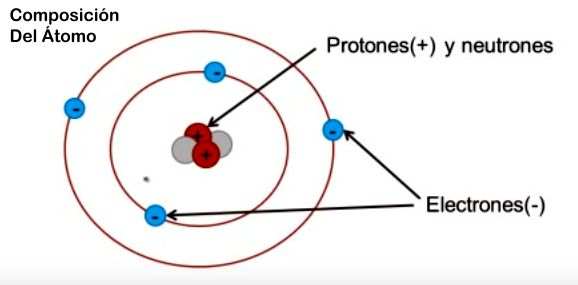
Esquema basico de un átomo

Historia de la Orgaización de los Elementos Químicos
Durante el siglo XIX Se acrecentó el interés por encontrar la manera de clasificar los elementos.
En 1869 el profesor de química de la universidad de San Petersburgo Dmitri Ivánovich Mendeléiev —un hombre liberal, feminista y excéntrico (sólo se cortaba el cabello una vez al año)— tuvo bastantes altercados con el gobierno zarista.
Dmitri Ivánovich Mendeléiev
Y el «memorándum» que distribuyó entre sus colegas en 1869 no impidió que el gobierno lo enviara varias veces al extranjero.
Se trataba sólo de un pequeño cuadro en el que los 63 elementos químicos conocidos aparecían ordenados por sus pesos atómicos, en orden creciente, y colocados de manera que los que tenían propiedades químicas parecidas estuvieran en una misma columna.
La extraña periodicidad que esta disposición revelaba parecía totalmente arbitraria, máxime cuando Mendeléiev había hecho algunos apaños, corrigiendo ciertos pesos atómicos para que cuadraran o dejando huecos poco verosímiles.
En 1869 el químico ruso Dimitri Mendeleyev ideó un ingenioso catálogo de los elementos, la tabla periódica.
Observó que los elementos parecen distribuirse en familias, que se repiten periódicamente, con propiedades químicas semejantes.
Siguiendo este criterio, anotó el símbolo químico y el peso atómico de todos los elementos conocidos y los ordenó, según su peso, en orden de menor a mayor; también colocó los elementos con propiedades semejantes en columnas verticales.
De este modo formó un esquema, una especie de mapa donde los elementos aparecen ordenados en familias verticales y en períodos horizontales.
El hidrógeno, el más ligero de los elementos, ocupa un lugar algo apartado del conjunto, debido a sus propiedades especiales.
En tiempo de Mendeleiev se creía que el átomo era indivisible, pero el descubrimiento de los rayos X y de la radiactividad provocaron la primera duda.
Actualmente sabemos que el átomo está constituido por tres clases principales de partículas: protones, neutrones y electrones.
Protones y neutrones constituyen el núcleo del átomo.
Los electrones, que giran en órbita alrededor del núcleo, determinan las propiedades químicas y, en consecuencia, la situación de los elementos en la tabla periódica.
A la izquierda de la tabla aparecen representaciones simplificadas de los átomos de los elementos pertenecientes a la familia de los metales alcalinos; sobre la misma se hallan los elementos del segundo período.
Esquema Elemetal Composición del Atomo

Adviértase que todos los metales alcalinos poseen un solo electrón en la órbita externa; precisamente esta estructura similar es causa de su semejanza en las propiedades químicas.
En el segundo período la situación es completamente diferente.
Aunque cada átomo tiene dos órbitas, varía el número de electrones de la exterior.
La diferencia de estructura provoca la diferencia de propiedades.
Según crece el número de electrones de la órbita exterior, las propiedades varían de izquierda a derecha, es decir, de los metales a los metaloides.
Cuando se completan los ocho electrones posibles de la órbita exterior (neón), concluye el segundo período.
El sodio, que inicia el tercer período, posee una órbita más con un electrón.
Los períodos aumentan y se hacen más complejos a medida que crece el número de órbitas.
También aumenta el número de electrones en las órbitas sucesivas.
Los átomos pesados son los menos estables: todos los elementos posteriores al bismuto, cuyo número atómico es 83, son radiactivos.
Los elementos reciben un nombre que responde en algúnos casos a raíces latinas, y en otro en honor a la persona que los descubre.
Éstos se abrevian en símbolos, si tiene una sola letras deberá, ser mayúscula y si lo componen dos, la primera mayúscula y la segunda minúscula por ejemplo nitrógeno (N) y sodio (Na), respectivamente.
PRIMERAS CLASIFICACIONES DE LOS ELEMENTOS QUÍMICOS:
• Las tríadas de Dobereiner:
En 1829, Dobereiner, químico alemán, clasificó los elementos conocidos.
Agrupaba tres elementos con características observables similares.
La clave de esta forma de organización era el hecho de que para uno de los elementos que formaban el grupo, la masa era el valor promedio de las masas de los tres elementos, por ejemplo (Li, Na, K) cuyas masas son 7, 23, y 39 gramos respectivamente.
Si sumas los tres datos y los divides entre el número de elementos (3) te da exactamente el valor de la masa del Na, el cual se ubica en la mitad.
Clasificación dispendiosa y no muy exacta para nuevos elementos.
• Octavas de Newlands:
En 1864, Newlands, químico inglés, clasificó los elementos en grupos de ocho, por lo que se conocen como octavas de Newlands.
Esta clasificación hacía alusión al término de periodicidad, ya que según la teoría, las propiedades de algunos elementos conocidos se repetían cada ocho elementos y básicamente las organizó en orden ascendente de sus pesos atómicos.
• Mendeleiev y Meyer:
• La Tabla Periódica:
En 1869 Dimitri Mendeleiev, químico ruso, retoma los estudios realizados anteriormente y basándose también en propiedades periódicas de los elementos, los organiza por orden de pesos atómicos ascendentes y, con algunas propiedades más, agrupó los elementos por familias en las que incluyó a los elementos con mayor cantidad de similitudes.
Paralelamente Meyer, físico alemán, realizaba estudios basado en los mismos principios, pero añadió estudios de algunas propiedades físicas, que también resultaron ser periódicas, tales como el radio atómico.
El gran aporte de Mendeleiev es la base de la tabla periódica actual, ya que dejó los espacios para elementos aún no descubiertos, que respondían a sitios vacíos en la tabla periódica.
REGIONES DE LA TABLA PERIÓDICA
La tabla periódica esta dividida a nivel general en metales y no metales.
Sin embargo, hay otra diferenciación, que la divide en regiones, división basada en los subniveles energéticos que ocupan los electrones del ultimo nivel.
Así la tabla periódica está dividida en la región s, la región p, la región d y la región f.
Por ejemplo, en la región s se ubican los elementos cuyos electrones finalicen su distribución en el subnivel s.
En esta sección nos ocuparemos de las regiones d y f de la tabla periódica, correspondientes a los elementos de transición.
• Elementos de transición
Los átomos de los elementos siempre tienden a ser estables energéticamente, por lo cual ceden, comparten o pierden electrones.
Esta estructura estable coincide cuando en su último nivel hay ocho electrones, pero en el caso de este grupo particular de elementos, se suspende el llenado del último nivel para completar primero el penúltimo nivel.
Por esta razón aunque los demás elementos de la tabla periódica tiendan a realizar sus enlaces utilizando los electrones del último nivel de energía, éstos lo hacen tanto con los electrones del último nivel, como con los del penúltimo.
Se caracterizan además, por poseer gran cantidad de estados de oxidación, es decir, que involucran diferentes cantidades de electrones para intervenir en un enlace, lo que hace que formen varios compuestos.
Los elementos que pertenecen a este grupo especial, son los pertenecientes a los lantánidos, actínidos y tierras raras.
• Electronegatividad
Si se analizan las propiedades de los elementos químicos, también se puede establecer que hay periodicidad teniendo en cuenta la electronegatividad de los elementos químicos, que básicamente es la tendencia que tienen los átomos de atraer o captar electrones; son ejemplo de ello el oxígeno y el cloro, ya que la electronegatividad aumenta en un periodo de izquierda a derecha y en un grupo de abajo hacia arriba.
Y si localizas estos dos elementos se ubican en los lugares más electronegativos de la tabla periódica.
Este concepto fue establecido por L. Pauling, quien determinó valores de electronegatividad para cada uno de los elementos; algunos ejemplos se muestran en la tabla que sigue:
| Na | Mg | Al | P | Cl | F | Br | I | At | Fr |
| 0.9 | 1.2 | 1.5 | 2.1 | 3.0 | 4.0 | 2.8 | 2.5 | 2.2 | 0.7 |
Por otra parte y como compensación, existe otro grupo de átomos que tiende a perder los electrones, siendo estos los electropositivos. Por ejemplo el sodio y el calcio al poseer solamente 1 y 2 electrones, respectivamente, en su último nivel tienden a cederlos.
De esta manera empieza también a evidenciarse la afinidad entre ellos, dado que el átomo que tiende a capturar se complementaría en un enlace químico con uno que tienda a ceder o perder electrones.
• Valencia
Para establecer de qué manera los átomos se relacionan, es necesario saber la cantidad de electrones que un átomo puede atraer (ganar), ceder (perder) o compartir con otro átomo, concepto que se conoce con el nombre de valencia.
La ilustración, muestra la forma como se relacionan dos átomos de dos elementos, para formar un compuesto: el átomo de sodio pierde un electrón, es decir su valencia es 1 y el átomo de cloro gana 1 electrón, entonces su valencia también es 1.
En síntesis, la valencia es el poder de combinación de un elemento con otro, dado por los electrones del último nivel.
• Enlace
La unión entre los átomos se denomina enlace, que es una fuerza de atracción lo suficientemente intensa como para permitir que los átomos involucrados funcionen como una unidad.
Se realiza básicamente entre los electrones del ultimo nivel de energía y se produce cuando las fuerzas de atracción superan las de repulsión, clasificándose, según la manera de establecer la unión.
Así pues:
Enlace iónico: se origina cuando un átomo cede y otro captura los electrones.
Enlace covalente: se origina cuando los átomos involucrados comparten sus electrones, dado que tienen la misma fuerza de atracción.
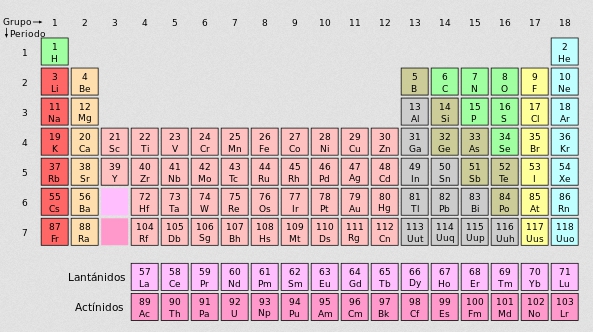

TABLA ACTUAL CON PESOS ATÓMICOS APROXIMADOS
| N° Atómico | Nombre Elemento | Símbolo | N° Protones |
N° Electrones | Peso Atómico |
| 1 | hidrógeno | H | 1 | 0 | 1,0 |
| 2 | helio | He | 2 | 2 | 4,0 |
| 3 | litio | U | 3 | 4 | 6,9 |
| 4 | berilio | Be | 4 | 5 | 9,0 |
| 5 | boro | 6 | 5 | 6 | 10,8 |
| 6 | carbono | C | 6 | 6 | 12,0 |
| 7 | nitrógeno | N | 7 | 7 | 14,0 |
| 8 | oxígeno | 0 | 8 | 8 | 16,0 |
| 9 | flúor | F | 9 | 10 | 19,0 |
| 10 | neón | Ne | 10 | 10 | 20,2 |
| 11 | sodio | Na | 11 | 12 | 23,0 |
| 12 | magnesio | Mg | 12 | 12 | 24,3 |
| 13 | aluminio | Al | 13 | 14 | 27,0 |
| 14 | silicio | Si | 14 | 14 | 28,1 |
| 15 | fósforo | P | 15 | 16 | 31,0 |
| 16 | azufre | S | 16 | 16 | 32,1 |
| 17 | cloro | Cl | 17 | 18 | 35,5 |
| 18 | argón | A | 18 | 22 | 39,9 |
| 19 | potasio | K | 19 | 20 | 39,1 |
| 20 | calcio | Ca | 20 | 20 | 40,1 |
| 21 | escandio | Se | 21 | 24 | 45,0 |
| 22 | titanio | Ti | 22 | 26 | 47,9 |
| 23 | vanadio | V | 23 | 28 | 50,9 |
| 24 | cromo | Cr | 24 | 28 | 52,0 |
| 25 | manganeso | Mu | 25 | 30 | 54,9 |
| 26 | hierro | Fe | 26 | 30 | 55,8 |
| 27 | cobalto | Co | 27 | 32 | 58,9 |
| 28 | níquel | Ni | 28 | 30 | 58,7 |
| 29 | cobre | Cu | 29 | 34 | 63,5 |
| 30 | cinc | Xn | 30 | 34 | 65,4 |
| 31 | galio | Ga | 31 | 38 | 69,7 |
| 32 | germanio | Se | 32 | 42 | 72,6 |
| 33 | arsénico | As | 33 | 42 | 74,9 |
| 34 | seienio | Se | 34 | 46 | 79,0 |
| 35 | bromo | Br | 35 | 44 | 79,9 |
| 36 | criptón | Kr | 36 | 48 | 83,8 |
| 37 | rubidio | Rb | 37 | 48 | 85,5 |
| 38 | estroncio | Sr | 38 | 50 | 87,6 |
| 39 | itrio | Y | 39 | 50 | 88,9 |
| 40 | zirconio | Zr | 40 | 50 | 91,2 |
| 41 | niobio | Nb | 41 | 52 | 92,9 |
| 42 | tnolibdeno | Mo | 42 | 56 | 95,9 |
| 43 | tecnecio | Te | 43 | 56 | (99) |
| 44 | rurenic- | Ru | 44 | 58 | 101,1 |
| 45 | rodio | Rh | 45 | 58 | 102,9 |
| 46 | paíadio | Pd | 46 | 60 | 106,4 |
| 47 | plata | Ag | 47 | 60 | 107,9 |
| ; 48 | cadmio | Cd | 48 | 66 | 112,4 |
| 49 | indio | In | 49 | 66 | 114,8 |
| 50 | estaño | Sn | 50 | 70 | 118,7 |
| 51 | antimonio | Sb | 51 | 70 | 121,8 |
| 52 | teluro | Te | 52 | 78 | 127,6 |
| 53 | yodo | 1 | 53 | 74 | 126,9 |
| 54 | xenón | Xe | 54 | 78 | 131,3 |
| 55 | cesio | Cs | 55 | 78 | 132,9 |
| 56 | bario | Ba | S6 | 82 | 137,3 |
| 57 | laura no | La | 57 | 82 | 138,9 |
| 58 | ceño | Ce | m | 82 | 140,1 |
| 59 | praseodimio | Pr | 59 | 82 | 140,9 |
| 60 | neodimio | Nd | 60 | 82 | 144,2 |
| 61 | prometió | Pm | 61 | 86 | (147) |
| 62 | samarlo | Sm | 62 | 90 | 150,4 |
| 63 | europio | Eu | 63 | 90 | 152,0 |
| 64 | gadolinio | Gd | 64 | 94 | 157,3 |
| 65 | terbio | Tb | 65 | 94 | 158,9 |
| 66 | disprosío | Dy | 66 | 98 | 162,5 |
| 67 | holmio | Ho | 67 | 98 | 164,9 |
| 68 | erbio | Er | 68 | 98 | 167,3 |
| 69 | tuiio | Tm | 69 | 100 | 168,9 |
| 70 | iterbio | Yb | 7© | 104 | 173,0 |
| 71 | lutecio | Lu | 71 | 104 | 175,0 |
| 72 | hafnio | Hf | 72 | 108 | 178,5 |
| 73 | tantalio | Ta | 73 | 108 | 180,9 |
| 74 | volframio | W | 74 | 110 | 183,9 |
| 75 | renio | Re | 75 | 112 | 186,2 |
| 76 | osmio | Os | 76 | 116 | 190,2 |
| 77 | iridio | Ir | 77 | 116 | 192,2 |
| 78 | platino | Pt | 78 | 117 | 195,1 |
| 79 | oro | Áu | 79 | 118 | 197,0 |
| 80 | mercurio | H9 | 80 | 122 | 200,6 |
| 81 | íalio | TI | 81 | 124 | 204,4 |
| 82 | plomo | Pb | 82 | 126 | 207,2 |
| 83 | bismuto | Bi | 83 | 126 | 209,0 |
| 84 | pofonio | Po | 84 | 125 | (299) |
| 85 | astatino | At | 85 | 125 | (210) |
| 86 | radón | Rn | 86 | 136 | (222) |
| 87 | francio | Fr | 87 | 136 | (223! |
| 88 | radío | Ra | 88 | 138 | (226,0) |
| 89 | actinio | Ac | 89 | 138 | (227) |
| 90 | torio | Th | 90 | 142 | (232,0) |
| 91 | protactinio | Pa | 91 | 140 | (231) |
| 92 | uranio | U | 92 | 146 | (238,0) |
| 93 | neptunio | Np | 93 | 144 | (237) |
| 94 | plutonio | Pu | 94 | 150 | (244) |
| 95 | americio | Am | 95 | 148 | (243) |
| 96 | curio | Cm | 96 | 151 | (247) |
| 97 | berkelio | Ble | 97 | 152 | (249) |
| 98 | californio | Cf | ?8 | 151 | (249) |
| 99 | einstenio | Es | 99 | 155 | (254) |
| 100 | fermio | Fm | 100 | 153 | (253) |
| 101 | mendelevio | Md | 101 | 155 | (256) |
| 102 | nobelio | No | 102 | 152 | (254) |
| 103 | laurencio | Lw | 103 | 154 | (257) |
• ►ALGO MAS...
EL GENIO INTRÉPIDO
A fines del siglo pasado flotaba ya en la atmósfera científica la idea de que al ordenar los elementos por peso atómico creciente aquellos de propiedades químicas comparables reaparecían en forma periódica.
Por ejemplo, la serie alcalina litio-sodio-potasio-rubidio-cesio, o los halógenos flúor-cloro-bromo-yodo (algunos fueron descubiertos después).
Pero, a pesar de que en los más livianos dicha repetición tenía lugar de ocho en ocho y en los más pesados cada dieciocho elementos, había muchas lagunas y contradicciones.
Dimitri Mendeleiev elaboró una tabla en cuyas casillas se ordenaban en forma horizontal los pesos atómicos y vertical las "familias" de elementos químicamente similares.
Ver Una Biografia y Su Obra Cientifica
Pero en su época se conocían menos de 45 cuerpos simples de los 103 que hoy forman la tabla periódica.
El mérito capital del sabio ruso consistió en considerar que las fallas y vacíos del cuadro no eran imputables a éste, sino a los químicos que aún no habían descubierto el elemento destinado a intercalarse en el lugar que se le reservaba.
Así Mendeleiev vaticinó sin errores el peso atómico probable de varios elementos desconocidos, sus propiedades químicas esenciales y hasta las probables combinaciones naturales en cuyo interior se ocultaban.
Hubo dificultades.
Fue necesario invertir, sin razón plausible, el potasio y el argón (hoy sabemos que una variedad de este último posee un neutrón más en su núcleo).
Tampoco se sabía que la primera órbita periférica del átomo se satura con dos electrones (hidrógeno-helio), la siguiente con ocho, etc.
Pero a pesar de su carácter empírico y sus enormes carencias, lo tabla de Mendeleiev resultó un armo prodigiosa para lo investigación científica y fue inmenso su buen éxito.
Fuente Consultada: Enciclopedia NUEVO Investiguemos Ciencia Integrada Tomo 3
Temas Relacionados:
Naturaleza de la Materia
Historia de la Quimica y sus Etapas Evolutivas
Berzelius Jacobo Creador del Lenguaje Cientifico
Fundadores de la Quimica Moderna
Breve Biografia de Kekulé Friedrich A.Vida y Obra del Quimico
Biografia de Lavoisier Antoine Descubrimientos en la Quimica
Enlace Externo:• La tabla periódica de los elementos químicos