El Atomo Para Niños y Principiantes:Explicación Sencilla y Practica
El Atomo Para Niños y Principiantes:Explicación Sencilla y Practica
►Los Materiales
La naturaleza nos muestra una multitud de objetos distintos formados por diferentes materiales, cuando vamos de paseo vemos correr el agua de un río, las piedras de grandes montañas, la tierra en los caminos, y seguramente vamos viajando sobre un automóvil que está construído con diversos y distintos materiales como: acero, plástico, tela, cuero, goma, etc.
Pero bien,...esos materiales ¿de que están hechos?,....esa pregunta también se la hicieron hace unos 2500 años en Grecia Antigua, grandes hombres dedicados a la ciencia , como Thales de Mileto, Empédocles y Demócrito, todos ellos vivieron entre 600 y 400 antes de Cristo y aquí te los presento:

Cada uno de ellos, y también otros pensadores mas, tenían su propia teoría o forma de explicar los elementos que constituían la materia, por ejemplo para Thales era el Agua, para Empédocles era no solo el Agua, sino también la Tierra, el Fuego y el Aire, es decir los cuatro elementos fundamentales.
Pero un día llegó el señor Demócrito de una ciudad griega llamada Abdera, y afirmó que para saber la composición de la materia, deberíamos ir cortándola por mitad sucesivamente.
Imagina una hoja de papel que la rompemos una y otra vez obteniendo en cada corte trozos más y más pequeños, ¿hasta dónde podrá continuar el proceso?.
Según su idea, de dividir constantemente un cuerpo de cualquier material, obtendríamos un trozo cada vez mas pequeño, hasta obtener una porción mínima que seria imposible volver a cortarla es decir, esa porción seria INDIVISIBLE.
A esta partícula la llamó átomo (palabra que en griego significa precisamente “no divisible”) y a su postura se la llama atomismo.
Ciertamente, estas conjeturas no estaban respaldadas por ningún tipo de experimentación y se debatían sólo en el ámbito del pensamiento abstracto que tanto amaban los griegos en sus fogosas discusiones.
► Dividamos Una Manzana Hasta El Átomo

Imagina que deseas conocer como está formada la manzana, para ello (según Demócrito) debes cortar indefinidamente la misma hasta llegar a una mínima porción "atómica", y ese es el elemento fundamental con la que está consituída la fruta.
El mundo material, el mundo que nuestros sentidos conocen está formado por gases, como el oxígeno de aire que respiramos en este momento o el hidrógeno, de líquidos, como el agua o el alcohol, de sólidos, como el hierro o el azúcar, o de las hojas, flores y frutos de un árbol, todos no son más que diferentes agrupaciones de un número inmenso de pequeñísimos de esos corpúsculos llamados átomos.
►Los Atomos
Los átomos son muy poco diferentes los unos de los otros, por ejemplo hay átomos del material HIERRO, átomos de OXIGENO, átomos de COBRE, átomos de CARBONO, etc.
En la naturaleza hay 103 elementos conocidos, entre naturales y artificiales (porque los ha hecho el hombre en el laboratorio, hoy puede haber algunos más).
Despúes de muchos años de experimentos e investigaciones los físicos del siglo XX pudieron penetrar dentro de "esa porción indivisible", y observaron que además existían otras partículas aún más pequeñas que los átomos y que eran las partes constituyentes del mismo.
►Dibujo de un Átomo y Sus Elementos
La forma de dibujar un átomo, es la siguiente:
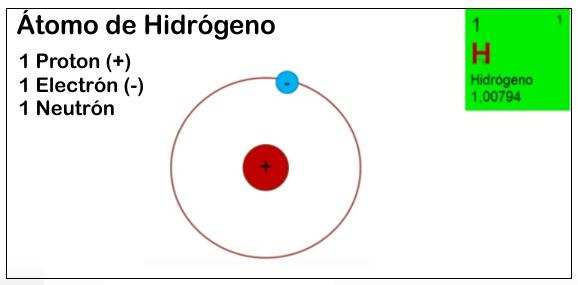
Los científicos notaron que el átomo tiene en su centro casi una "esferita" que en su interior contiene dos partículas llamada: PROTONES Y NEUTRONES.
Por otro lado también observaron que alrededor de ese núcleo, giraban a gran velocidad otras partículas más pequeñas que las del núcleo y las llamaron: ELECTRONES.
Las partículas ELECTRÓN Y PROTÓN, tienen una carga eléctrica, en el primero la carga es NEGATIVA y el segundo la carga eléctrica es POSITIVA. Los NEUTRONES no poseen carga y el nombre deriva de la palabra "neutro".
El atómo está equilibrado eléctricamente, es decir por ejemplo, que si hay 10 electrones girando (10 cargas negativas), también ese átomo tiene 1o protones en su núcleo (10 cargas positivas)
En el esquema de abajo, vemos el átomo de HELIO, material con que están hechas las estrellas. Tiene dos protones y dos electrones. La cantidad de neutrones es variable, aqui también tiene dos.
►Composición del Átomo
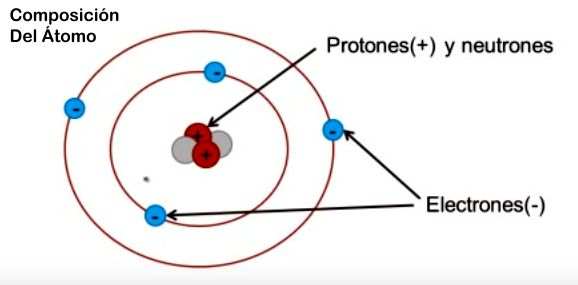
¿Que es lo que hace que un material sea Hierro, otro Helio y otro por ejemplo Oro?...LA CANTIDAD DE PROTONES contenidos en el núcleo, cantidad que se denomina: NÚMERO ATÓMICO, en el caso del esquema: Na=2
A la suma de la cantidad de protones mas neutrones la llamamos: NUMERO MÁSICO, y en el caso que nos ocupa es: Nm=2+2=4.-
Esos mas de 100 elementos que forman la naturaleza, fueron agrupados en una tabla para ser estudiados y se la llama: Tabla Periódica de los Elementos Químicos o también Tabla de Mendeleiev
►Tabla Periódica de los Elementos Químicos
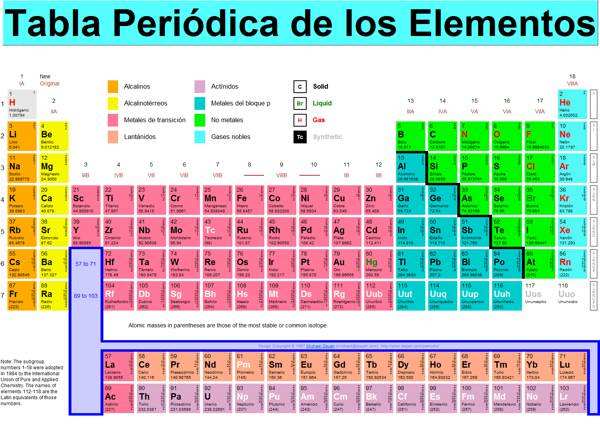
► Número Atómico
Observa que cada elemento (químico) tiene una ubicación, y el orden es por el Número Atómico de cada elemento: primero es el HIDRÓGENO, con un protón, le sigue el HELIO con dos protones, luego el LITIO con tres protones, el BERILIO con cuatro protones, y asi hasta el último elemento N° 103 , llamado LAWRENCIO.
Hay otros números en columna a la derecha, que luego veremos y nos muestra las capas y subcapas de los electrones. Los colores de los grupos es para diferenciar los tipos de elementos, entre alcalinos, lantánidos, no metales, metales ,etc. cada uno con sus propias características, como el brillo, conductividad electrica, etc.
► Las Medidas del Átomo
Para los seres humanos es muy díficil imaginar distancias tan pequeñas, como es de la partículas atómicas, pero podemos decir que esas partículas, tienen un diámetro medio de unas diez millonésimas de milímetro, se necesitarían más de diez millones de ellas colocadas en línea recta para tener un milímetro de longitud.
1 mm.= 10.000.000 de partículas
El núcleo, que es parte predominante, es decir, la mas grande, de forma esférica, que posee un radio de unos 0,0000000000001 centímetros, UN UNO CON TRECE CEROS, como se puede ver es una medida sumamente chica para poder imaginarla. El diámetro de los electrones es aún mas pequeño.
Respecto al peso de esas partículas, no vamos a dar números, pero es un UNO CON VEINTIOCHO CEROS de gramo, y el peso del protón es 1836 veces el peso del eléctrón.
A este concepto le llamamos MASA DE LA PARTÍCULA.
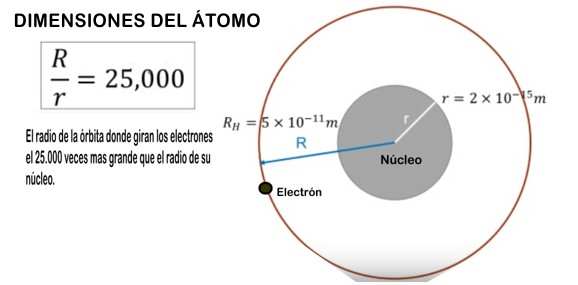
Dijimos que los electrones giran muy rapidamente alrededor del nucleo, en una trayectoria circular, y el radio de esa circuferencia es de UN UNO CON 11 CEROS de metro, 0,00000000001 m. Para las dimensiones del átomo esa medida es grande, porque esa medidas es 25.000 veces mas grande que el radio del núcleo.
Para llevarlo a una escala "mas humana", piensa que si el nucleo tiene la medida de una moneda, el radio del electrón seria de unos 250 metros.
Presentamos un esquema aproximado de las dimensiones a modo de aclarar un poco mas la idea, pero como consejo solo trata solo de recordar que un átomo mide 10.000.000 veces que 1 metro.
► NIVELES DE ENERGIA DE LOS ELECTRONES
Debemos aclarar que esas partículas son tan pequeñas que no pueden observarse, y cuando enviamos un rayo de luz para intentar verla, esa partícula cambia de posición en el mismo instante, entonces es imposible hablar de la posición exacta en el espacio que rodea al núcleo.
Como consecuencia nació a principio del siglo XX una nueva física, conocida como física cuántica, que recurre a la PROBABILIDAD de encontrar o "ver" un electrón en la región que rodea al núcleo de un átomo.
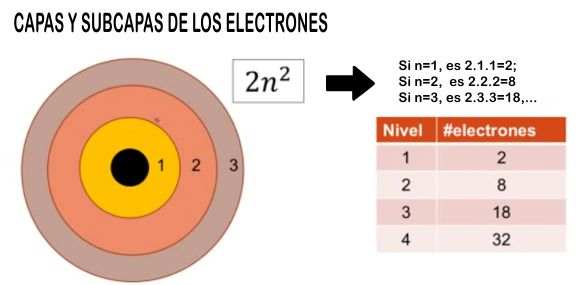
A partir de ese concepto hablamos de la CERTEZA de que un electrón se encuentre girando en cierta área que rodea al núcleo. Existen varias áreas o regiones de giro, y cada una le corresponde lo que llamamos NIVEL DE ENERGIA, para cada nivel hay un NÚMERO MAXIMO de electrones que pueden girar. Hay una fórmula muy simple que permite determinar la cantidad de electrones por nivel de energía o CAPA, y es la siguiente: 2.n².
Observa como se calcula el número de electrones por cada nivel en el esquema de abajo, usando la fórmula anterior.
Y finalmente cada nivel tiene un subnivel o subcapa que también permite que en esa zona giren electrones, a cada subnivel se lo llama. s , p , d , f, y el máximo de electrones es de 2, 6, 10 y 14 respectivamente.
Puedes observar la tabla siguiente:

Resumiendo lo antedicho, podemos concluír que:
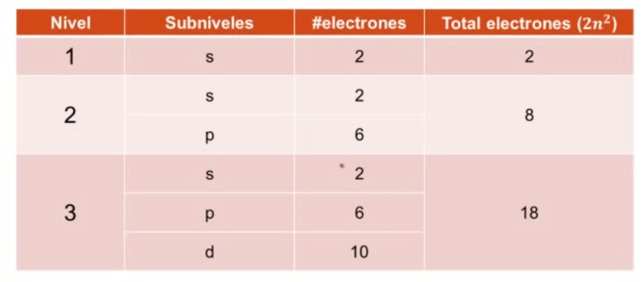
Entonces para el nivel es el 1, sabemos que solo puede contener 2 electrones, por lo que el nivel 1 tiene una subcapa llamada s, que permite 2 electrones.
Para el nivel 2, la cantidad de electrones es de 8, por lo que tendrá dos capas, la s y la p, con 2 y 6 electrones, es decir 8 en total.
Para el nivel 3 , la cantidad de electrones es de 18, entoces tendra tres capas, s, p y d , con 2, 6 y 10 electrones y l suma es 18.
En la tabla siguiente lo podemos analizar mas fácil, para tres capas.
Entonces veamos por ejemplo ahora el átomo de NIQUEL, que según la tabla de los elementos nos indica que tiene 28 protones, entonces el numero de electrones también será de 28, y estarán ubicados de la siguiente manera:
En el NIVEL 1, tendrá 2 en la subcapa s , + NIVEL 2 con 8 en dos cubcapas ( s, p) + NIVEL 3 con 18 en tres subcapas (s,p,d), cuya suma es de 28 electrones.
►Para Saber Mas!...
► La Energía Nuclear
Los átomos de un elemento tienen siempre el mismo número atómico, pero pueden poseer distinto número de masa, por contar con un número diferente de neutrones; tales átomos se denominan isótopos.
El edificio del átomo, centro de enormes fuerzas que se ejercen entre cargas opuestas, no presenta una estabilidad ilimitada.
El núcleo puede desintegrarse y liberar energía atómica, más correctamente energía nuclear, pues el proceso tiene lugar directamente en el núcleo del átomo.
Los fenómenos que conducen a la liberación de tal energía son la fisión y la fusión de núcleos.
La fisión, traducción fonética de la voz inglesa fission, significa escisión, división o partición de la masa de un núcleo pesado en dos fragmentos, que originan los núcleos de otros dos átomos más livianos y de pesos atómicos más o menos iguales, y la fusión, unión de dos núcleos de átomos livianos para formar el núcleo de uno más pesado.
En ambos casds, la liberación de cantidades extraordinarias de energía se debe a la transformación de cierta cantidad de masa de los núcleos de los átomos originales de energía. Esta se determina por medio de la fórmula:
E = m.c², establecida por Albert Einstein.
En ella, E es la energía liberada, m la masa transformada y c la velocidad de la luz.
Gracias a dicha transformación, destrucción o aniquilamiento de la masa o materia se puede, de una pequeña cantidad de ella, obtener una cantidad enorme de energía.
Así, de la fisión de 1 kilogramo de uranio puede obtenerse una cantidad de energía equivalente a la que produce la combustión de 2.500 toneladas de carbón.
Las aplicaciones de la energía nuclear son numerosas.
La bomba atómica o bomba A y la bomba de hidrógeno o bomba H se pueden emplear para excavar grandes canales, demoler rocas, etc.
Los reactores nucleares sirven para producir energía eléctrica, así como para propulsar buques.
También se utilizan piara obtener isótopos artificiales que tienen aplicaciones en medicina, agricultura e industria.
Fuente Consultada:
CIENCIA JOVEN Diccionarios Enciclopedico Tomo V - El Átomo y su Energía-
Temas Relacionados:
Cálculo del Radio de la Orbita en el Átomo de Hidrógeno
El Atomo:Composicion, Energia Nuclear,Electrones, Protones
Teoría de Desintegración Nuclear del Átomo Radioactividad
Biografía de Rutherford y Su Modelo Atomico del Atomo
Resumen de la Teoria Atomica Historia y Fundamentos de la Física
La materia y los cuatro elementos tierra agua fuego aire
Enlace Externo:• El átomo, como no te lo enseñaron en la escuela






