Modelo Atómico de Bohr Niels Resumen de su Biografia e Investigación
Modelo Atómico de Bohr Niels Resumen de su Biografia e Investigación

El nombre de Niels Bohr (1885-1962) se inscribe como uno de los nombres más ilustres de la física del siglo XX.
En líneas generales, tuvo la idea de aplicar la teoría de los quanta de Planck al modelo atómico de Rutherford, consiguiendo, de este modo, explicar la emisión de rayos espectrales y, al mismo tiempo, interpretar muchas propiedades físicas y químicas de los cuerpos.
En el tercer congreso de Física Solvay, que tuvo lugar en Bruselas el año 1921, a Rutherford se le preguntó qué diferencia existía, en su modelo atómico, entre los electrones nucleares y los periféricos.
Rutherford respondió con aquella frase que tanta popularidad alcanzó: «No man's land.», que significa "tierra de nadie".
Es decir, trató de sintetizar el concepto que había guiado a su escuela hasta el año 1911: el átomo está dividido en dos regiones, la interna y la externa, el núcleo y el sistema electrónico, separadas por una barrera infranqueable, en el sentido de que ni los electrones periféricos pasan al núcleo ni los constituyentes del núcleo pasan al sistema electrónico.

El mérito de Rutherford fue el de haber intuido que los fenómenos radioactivos tienen su sede en el núcleo, y que dedicándose al estudio de esta ciencia hizo desviar los problemas inherentes al sistema electrónico hasta la crítica fundamental que había expuesto.
Ciertamente, el modelo de Rutherford está en contradicción con el electromagnetismo clásico, sobre cuyos pormenores no se entrará.
Sencillamente se remarcará, con el objeto de centrar el problema histórico que limita la biografía de Niels Bohr, que cuando Rotherford estaba sumido en dicha problemática, el entonces joven investigador Bohr pasó al laboratorio de este otro físico inglés.

EL FENÓMENO FÍSICO:
Cuando un cuerpo sólido se calienta suficientemente, se pone incandescente, es decir, emite luz. Lo mismo sucedería si calentásemos gases o vapores, o si excitásemos sus moléculas con una descarga eléctrica.
Entre la luz emitida en uno u otro caso, existe, sin embargo, una importante diferencia.
Si hacemos que la luz emitida atraviese un prisma, o una red de difracción, se obtiene su espectro, o conjunto de rayas o bandas de los distintos colores que componen la luz incidente.
El espectro de la luz (imagen abajo) que emiten los sólidos incandescentes es continuo y presenta bandas de diferentes colores que se funden unos con otros. Los gases y vapores dan lugar a un espectro que presenta líneas o bandas discretas.
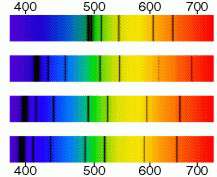
Un elemento dado presenta siempre un mismo espectro, lo que constituye un valioso método para su identificación.
Por ejemplo, al excitar el hidrógeno contenido en un tubo de descarga, se obtiene su bien conocido espectro de líneas.
Con el fin de explicar este espectro del hidrógeno.
Niels Bohr propuso su modelo atómico, que se utiliza todavía, aunque con algunas modificaciones, para describir los fenómenos atómicos básicos.
Niels Henrik David Bohr nació en octubre de 1885.
Su padre era profesor de fisiología en la Universidad de Copenhague.
En 1903, ingresó Bohr en dicha Universidad, y, ocho años después, salía de ella con el título de doctor y un enorme interés por los problemas teóricos relativos al átomo.
Bohr es un sabio de nuestro tiempo.
Murió el 18 de noviembre de 1962.
Desde muy joven hasta los últimos días de su existencia, Niels Bohr mostró un enorme interés y una incansable actividad en la solución de los problemas más importantes de la física moderna.
En 1911, Bohr llegó a Inglaterra para trabajar en el laboratorio Cavendish de Cambridge, bajo la dirección de J. J. Thomson.
Por entonces, los físicos que trabajaban en aquel laboratorio concebían el átomo, de acuerdo con otros muchos físicos del mundo, como una esfera cargada positivamente, que contenía los electrones (cargas eléctricas negativas), los cuales se movían dentro de la esfera, y en número tal que el átomo quedaba eléctricamente neutro.
Al cabo de pocos meses, Bohr se trasladó a Manchester, en donde Rutherford, uno de los mejores físicos del momento, era profesor de física.
Rutherford había demostrado, experimentalmente, que el átomo tenía un núcleo pesado de pequeño volumen y cargado positivamente, el cual estaba rodeado por los electrones.
Pero las características de los espectros atómicos no podían ser explicadas sobre la base del átomo de Rutherford.
Cuando Bohr regresó a Copenhague después de haber trabajado con J. J. Thomsom, el descubridor del electrón, en el Laboratorio Cavendish de la Universidad de Cambridge, Inglaterra, como discípulo y colaborador de Rutherford, ya estaba convencido de que las teorías clásicas de la física no eran capaces de representar adecuadamente los movimientos orbitales de los electrones.
Bohr combinó el núcleo de Rutherford y la teoría de los quanta de Plank y produjo la primera imagen matemática satisfactoria de la estructura del átomo, su teoría cuántica de las partículas fundamentales y de sus interacciones.
De acuerdo con su modelo, los electrones giraban alrededor del núcleo, cargado positivamente, y la atracción electrostática compensaba la fuerza centrífuga.
La teoría electromagnética clásica exigía, sin embargo, que toda carga eléctrica acelerada debería emitir radiación continua.
Si esta radiación continua tuviese lugar, los electrones, entonces, describirían una espiral descendente y caerían al núcleo.
El átomo de Rutherford era, por tanto, inestable, de acuerdo con los principios de la mecánica clásica.
Por otro lado, la emisión espontánea que predecían las leyes de la teoría electromagnética no tenía, de hecho, lugar.
Bohr se dedicó a plantear y estudiar los problemas teóricos que el átomo de Rutherford llevaba consigo, con el objeto de proponer un modelo atómico que se ajustase a los hechos experimentales conocidos entonces, y, particularmente, a la evidencia que con el empleo del espectroscopio se había acumulado empíricamente, analizando los espectros de elementos conocidos.
SU MODELO ATÓMICO PROPUESTO:
La teoría de Bohr puede resumirse en los dos puntos siguientes:
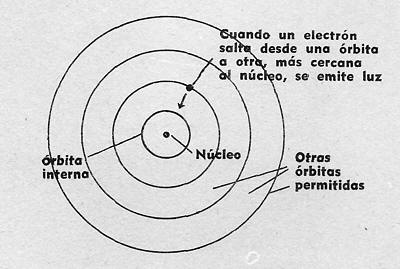
1) Los electrones sólo pueden ocupar ciertas capas en órbitas, dentro del átomo. A los electrones de una determinada órbita les corresponde una energía bien definida.
2) Cuando un electrón salta desde una a otra de las órbitas permitidas de un átomo, éste emite luz.
Puesto que cada órbita representa un determinado estado energético, a la transición producida le corresponde un incremento de energía bien definido.
Este cambio en la energía del electrón conduce a la emisión de luz de una determinada frecuencia, la cual es proporcional a la diferencia entre las energías de los niveles inicial y final.
Cuando se aplicaron estas ideas al átomo de hidrógeno, que es el átomo más simple, ya que está constituido por un solo electrón girando alrededor del núcleo, se encontró que proporcionaban, exactamente, el mismo espectro que se había medido de un modo experimental.
Nueve años después, en 1922, Bohr recibía el Premio Nobel de física, por su interpretación del espectro del hidrógeno, basada en su modelo atómico.
La importancia de este revolucionario modelo atómico no necesita ser comentada, y su inmediata aplicación para explicar el espectro del hidrógeno ha sido calificada como uno de los mayores triunfos de la física.
En su laboratorio de Copenhague trabajaban la refugiada judía Lise Meitner y su sobrino Otto Frisch.
Cuando los alemanes Hahn y Strassman publicaron los resultados de sus investigaciones sobre el bombardeo de átomos de uranio con neutrones, descubriendo con asombro que aparecían pequeños indicios de bario y criptón, sin determinar su origen.
Bhor se entusiasmó con la idea propuesta por Meitner y Frisch de que tal vez el uranio absorbía un neutrón que se dividiera en dos fragmentos más o menos iguales.
Bohr viajó a Estados Unidos donde se reunió con Einstein y Fermi. Allí recibió una comunicación de sus colaboradores Meitner y Frisch quienes le avisaban que al repetir el experimento comprobaron que el núcleo de uranio se había dividido.
Lo que fue discutido entre los tres sabios, sacando las consecuencias en cuanto a la enorme obtención de energía según este proceso
Desde 1913, y con sólo unas modificaciones efectuadas en la tercera década de este siglo, el modelo atómico de Bohr ha sido fundamental en la descripción de los procesos atómicos.
Durante estos años, fueron explicándose, progresivamente, muchos fenómenos no totalmente comprendidos o interpretados: la estructura de los espectros de otros elementos, los procesos de absorción y emisión luminosa, la formación del sistema periódico de los elementos, las propiedades periódicas de las 92 especies atómicas entonces conocidas, etc.
En 1920, fue fundado el Instituto de Física Teórica de Copenhague, del que Niels Bohr fue nombrado director, centro que desde entonces ha permanecido a la vanguardia de la física teórica nuclear.
Los mejores físicos del mundo hacían frecuentes visitas a este instituto, para discutir con Bohr las modificaciones de su teoría.
Niels Bohr, el modesto físico danés que nació antes de que la radiactividad fuese descubierta y que llegó a ser una máxima autoridad en el estudio de las leyes fundamentales del átomo, murió en noviembre de 1962.
En el modelo atómico propuesto por J. J. Thomson en 1904, se suponía que los electrones estaban contenidos en una esfera cargada positivamente, y que la masa del átomo era fundamentalmente debida a los electrones.
En el modelo del átomo de hidrógeno propuesto por Bohr, el electrón puede moverse a lo largo de ciertas órbitas situadas alrededor del núcleo: cuando un electrón salta de una órbita a otra más cercana al núcleo, el átomo emite luz de un cierto color, que depende de las órbitas que entran en juego.
Así, si un átomo de hidrógeno no está excitado, se encuentra en su estado normal y los electrones están situados en la órbita más cercana al núcleo, con lo que no puede producirse emisión de luz alguna.

UNA VIDA DE TRABAJO:
Un hombre dedicado totalmente al trabajo, nos recuerda la clásica imagen del hombre que en las profundidades de su laboratorio sabe encontrar las verdades de la naturaleza.
Poco amigo de los reconocimientos, carácter sencillo y afable, profundiza en sus primeros hallazgos.
En 1922, cuando contaba treinta y siete años, recibió el Premio Nobel de Física.
En estos seis años, sobreponiéndose a las consecuencias de la primera gran guerra, había demostrado que el edificio atómico se complica progresivamente a medida que uno se eleva en la escala de Mendeléiev.
Niels Bohr sacó una serie de conclusiones en lo tocante a los lechos y niveles de electrones intraatómicos, así como también sobre las correlaciones existentes entre esta edificación progresiva y la variación concomitante de las propiedades de los elementos; estas investigaciones tan importantes tuvieron una gran resonancia y la ley de saturación de los niveles electrónicos que condujo a precisar, tal como apunta Louis de Broglie, puede ser puesta en relación estrecha con el principio de exclusión poco más o menos enunciado por W. Pauli.
Gracias al esfuerzo de Niels Bohr, pues, la nueva mecánica nació alrededor del año 1925.
Apareció bajo dos formulaciones, equivalentes y digamos por azar simultáneas, que fueron la mecánica de matrices de Heisenberg, Born y Jordán y la mecánica ondulatoria de Schródinger.
El primero de estos principios había partido del análisis de la teoría de los quanta formulado por Niels Bohr.
La segunda proposición, en cambio, se originó sobre las ondas de la materia y gracias a los trabajos de Louis de Broglie.
Siguiendo este proceso histórico, la equivalencia de ambas formulaciones la demostró Schródinger.
Pero la formulación coherente de la teoría, su extensión y aplicación al campo electromagnético, o sea la mecánica quántica relativista del electrón, fue llevada a cabo por Dirac.
Es decir, Niels Bohr, que al parecer era un matemático mediocre, no participó, esto es de un modo directo, en la creación definitiva de la nueva mecánica; su colaboración fundamental se sitúa en lo que hace referencia a la interpretación física de la teoría, o, si se quiere, a través de una de las intuiciones más geniales que podemos registrar en la ciencia contemporánea.
El trabajo científico de Bohr se vio interrumpido por la invasión alemana, que le obligó a dejar su país.
Con anterioridad, aun en Copenhague, se convirtió en el protector de los judíos expulsados.
Muchas son las muestras que jalonan su espíritu generoso, con una gran dureza crítica, enfrentándose éticamente contra la ideología nazi.
Pues bien, a la entrada de los alemanes, en 1943, a través de Suecia se dirigió a Inglaterra y, finalmente, a los Estados Unidos; con un renombre universal, los norteamericanos le dieron toda clase de facilidades, prácticamente dirigiendo uno de los principales centros de investigación, aunque en aquel entonces las búsquedas en este campo sufrían la presión de las necesidades bélicas.
Niels Bohr trabajó en Los Álamos, contribuyendo a la fabricación de la bomba atómica. Consciente de las consecuencias que ello podía reportar, en el mes de julio de 1944 escribió un Memorándum dirigido a Roosevelt y Churchill, advirtiendo de las consecuencias y proponiendo la colaboración para la búsqueda y control de las armas nucleares. Pero no dio ningún resultado.
Niels Bohr regresó a su ciudad natal en 1945, siendo nombrado presidente de la Academia de Ciencias danesa. Trabajando en relación con el CERN de Genova, hizo cuanto pudo para tratar de perfeccionar, y llevar a límites pacíficos, las búsquedas teóricas de este importante centro de estudios nucleares.
Su fin estaba próximo, aunque la actividad científica seguía suscitando, orientando y comentando los trabajos de sus discípulos.
Pero el 18 de noviembre de 1962 de una forma súbita falleció; hay quien dice, con razón profunda, sintiendo el drama de conciencia —como también lo sintieron Einstein y Oppenheimer— de haber hecho posible la bomba atómica; realmente, de sus setenta y siete años de vida, los veinte últimos fueron un esfuerzo para evitar el desastre.

ALGO MAS SOBRE LA BIOGRAFÍA DE NEILS BOHR:
Fue Niels Bohr, quien llevó a los Estados Unidos la noticia de que en 1939, Lise Meitner y O. R. Frisch habían dividido el átomo de uranio.
No mucho después de que Bohr regresó a Copenhague, de aquel importante viaje, los nazis ocuparon Dinamarca.
Bohr ordenó inmediatamente que todo el trabajo se detuviera en su instituto de física teórica.
Después, en 1943, cuando se enteró de que iba a ser arrestado, escapó a Suecia con su esposa y su hijo Aage.
Pronto se encontró de nuevo en los Estados Unidos.
A mediados del año de 1940, un cierto Mr. Nicholas Brown iba, a menudo, a Los Álamos, Nuevo México, donde se construía la primera bomba atómica.
Para mucha gente era sólo un científico más del proyecto, pero para otros era probablemente, una figura familiar.
Los que le reconocían debían preguntarse,
"¿Mr. Brown? —Se parece a . . .", y se callaban, porque no debían circular las noticias de que el gran Niels Bohr estaba ayudando a los Estados Unidos a desarrollar la energía atómica.
Bohr estaba angustiado con la bomba. Incluso antes de que fuera usada por primera vez, intentaba persuadir a la gente de la necesidad de regular esta nueva forma de energía.
En 1950, escribió a las Naciones Unidas sobre la importancia del control internacional de la energía atómica.
En 1955, ayudó a organizar en Ginebra la Conferencia de Átomos para la Paz.
En 1957, —treinta y cinco años después de haber recibido el Premio Nobel de Física— se le concedió el primer Premio de Átomos para la Paz.
Bohr fue, probablemente, el más grande de todos los físicos atómicos.
En 1913, utilizó la teoría cuántica para explicar las líneas espectrales del hidrógeno.
Sabía que su teoría atómica no era aplicable para otros elementos y continuó mejorándola.
Desarrolló importantes teorías sobre la naturaleza del núcleo.
Tal vez, tan importante como sus investigaciones, fue su trabajo de maestro.
Muchos grandes físicos nucleares estudiaron con él.
En una serie de tributos a Bohr, en su cumpleaños, algunos de sus antiguos discípulos famosos, le presentaron parodias sobre informes de importantes investigaciones.
Se pueden ver algunas de estas divertidas narraciones en el número de marzo de 1956 del Scienfifíc American.
Fuente Consultada:
Revista TECNIRAMA N°56
El Estallido Científico en el Siglo XX Trevor Williams
FÍSICA Fundamentos y Fronteras Stollberg-Hill
Enlace Externo: El Atomo de Niel Borh





