Conceptos de Fisica Cuantica y Cientificos Que La Desarrollaron
Conceptos Basicos de Fisica Cuantica y Los Cientificos Que La Desarrollaron
 Efecto Fotoeléctrico |
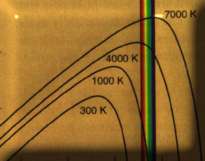 Radiación de un Cuerpo Negro |
 El Cuanto de Energía |
La física del siglo XIX creyó posible dar una solución sencilla a todos los problemas de la materia y de la energía.
Creía en principios que la parecían inviolables: invariabilidad de la masa, carácter inalterable e indestructible del átomo, transmisión de toda especie de energía en forma de ondas mensurables a partir de un determinado medio: el éter.

En 1865, James Clark Maxwell (1831-1879) publicó su célebre teoría electromagnética de la luz que demostraba magistralmente la identidad de las dos formas de energía luminosa y electromagnética.
La experiencia demostraría que, al igual que la onda luminosa, la onda electromagnética se refleja y se refracta.
Parecía como si se hubiese encontrado la solución definitiva de todos los problemas de la física generalizando el concepto de movimiento vibratorio y aplicándole los principios de la mecánica general.
Esta hermosa seguridad resultaría ilusoria.
Poco a poco fueron surgiendo inquietantes fenómenos que parecían dar al traste con las hermosas certezas sobre las que ya se comenzaba a descansar.
Primero fueron los rayos catódicos y la radiactividad, descubrimiento que circunstancias en parte fortuitas hicieron surgir a pocos meses de diferencia uno de otro y que eran la consecuencia de una larga serie de investigaciones cuyo origen se remontaba a unos doscientos años.
El espacio interior del átomo:
Mientras unos científicos investigaban paralelamente el tiempo a escala geológica y el espacio a escala universal —ambos parecían dilatarse—, otros dedicaban su atención al mundo microscópico del átomo.
A principios de siglo, muchos hombres de ciencia opinaban aún que estos estudios consistían en lucubraciones quizá sólo útiles para los químicos.
Sin embargo, pronto se supo que los átomos, aunque invisibles (sus diámetros son del orden de una diezmillonésima de milímetro), eran absolutamente reales, y se acometió seriamente la tarea de investigar su tamaño y estructura.
El físico británico J. J. Thomson detectó en 1897 los electrones con su carga eléctrica, pero sólo después de 1914 el norteamericano Robert Millikan logró aislar el electrón y medir su carga.
Rutherford utilizó partículas alfa (consistentes en dos protones y dos neutrones) en sus experimentos, 20 años antes de que el protón fuera aislado y denominado por su nombre en 1920; el neutrón, tercero de los componentes del núcleo, no fue descubierto hasta 1932. (ver: El Átomo)
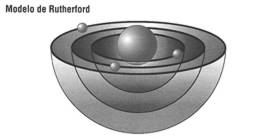
Hacia la Primera Guerra Mundial ya se sabía que en el espacio interior del átomo existe un mayor vacío que en el universo astronómico: la inmensa mayoría de su masa se concentra en el núcleo, que sólo ocupa una diezmilésima parte del volumen total, modelo atómico conocido, como Modelo de Rutherford.
Si el sol, por ejemplo, fuera del tamaño de una pelota de golf, Plutón, el planeta más lejano, se hallaría a 188 metros de distancia.
Pero si el núcleo de un átomo fuera la citada pelota, sus electrones exteriores se hallarían a unos 1.070 metros.
A pesar de la complejidad existente en el interior del átomo, su exploración progresó con sorprendente rapidez.
Transcurrieron 11 años desde que en 1895 el físico francés Henri Becquerel descubrió la radiactividad natural hasta que Boltwood la utilizó para calcular la edad de la Tierra.

Otros 11 años después, Rutherford hizo realidad el sueño de los alquimistas y transformó unos elementos en otros.
Aunque la fisión atómica no llegaría hasta mucho más tarde, ya antes de 1920 algunos físicos extendieron aún más su mirada: hacia el proceso de fusión atómica -aun mas poderoso-, fundamento del sol y de todas las estrellas del universo.
LA FÍSICA CUÁNTICA: El cuanto de Planck y el modelo atómico de Bohr
El modelo atómico de RUTHERFORD tenía en realidad una capital deficiencia.
Una partícula cargada, un electrón, desplazándose en el interior del átomo, debía -según la física clásica-emitir energía, radiar.
Perdiendo así continuamente energía, su trayectoria se estrecharía y el electrón terminaría por precipitarse en el núcleo atómico.
En una palabra, el átomo se aniquilaría a sí mismo.
El modelo de RUTHERFORD, salido del experimento y admirable desde tantos puntos de vista, venía a chocar con una fundamental exigencia de la electrodinámica maxwelliana.
Aceptar el primero era rechazar en el dominio microcósmico tal electrodinámica de MAXWELL.
La física no podía salir del dilema más que al precio de una infracción.
En realidad, el instrumento que iba a permitir "salvar los fenómenos" estaba ya formado desde hacía más de una década.
Sólo era preciso emplearlo.
 Al buscar la solución de un problema especial -la distribución de la energía en la radiación del cuerpo negro-, el físico alemán MAX PLANCK (1858-1947) llegó, en 1900, a una conclusión muy general.
Al buscar la solución de un problema especial -la distribución de la energía en la radiación del cuerpo negro-, el físico alemán MAX PLANCK (1858-1947) llegó, en 1900, a una conclusión muy general.
La energía radiante, admitió PLANCK, no es emitida por su fuente ni absorbida por la materia en forma de flujo continuo infinitamente divisible, sino de manera discontinua, en pequeños manojos, en cantidades finitas.
Todo ocurre como si, después de haber emitido un tren de ondas, el átomo se detuviera antes de enviar otro.
La radiación, y en general cada intercambio energético, posee una estructura discontinua, variando a saltos, escalonadamente, siendo cada peldaño el producto de la frecuencia de la radiación considerada y de una constante de la naturaleza: la célebre constante de PLANK.
Estos escalones o granos de energía son los cuantos.
Con los cuantos de PLANCK se introduce en la ciencia una nueva idea, por completo desconocida de los investigadores clásicos y mucho más revolucionaria que la relatividad einsteniana.
En efecto, desde NEWTON, la imagen física del mundo del estaba basada en la convicción de que los fenómenos de la naturaleza son continuos.
Natura nonfacit saltus: la naturaleza no da saltos, repitieron físicos y filósofos de los siglos pasados, PLANCK y sus adeptos declararon que la naturaleza no da saltos.
------------- 00000 ------------

MAX PLANCK había avanzado en 1900 la hipótesis de que la energía era emitida y absorbida por cuantos, paquetes de energía cuyo valor está ligado a la frecuencia f de la radiación por medio de una constante h (llamada «constante.de Planck»): E = hf.
Esta idea pareció menos absurda cuando Einstein, cinco años después, explicó de la misma manera el efecto fotoeléctrico, descubierto por H. Hertz en 1886, consistente en el desprendimiento de un flujo de electrones por un metal sometido a una radiación ultravioleta.
Para Einstein, los corpúsculos luminosos son portadores de una energía proporcional a su frecuencia, que comunican a los electrones de los átomos metálicos.
------------- 00000 ------------
La constante de PLANCK, el cuanto elemental h, es el que mide los saltos en los intercambios de energía; su valor numérico es sumamente pequeño: 6,55 x 10-27.
Utilizando una imagen grosera podría decirse que la relación del número uno con el número h es -más o menos- la de la masa del globo terráqueo con la masa de una cabeza de alfiler.

La pequeñez del cuanto elemental es la que nos esconde en los intercambios energéticos -por ejemplo, en la emisión y absorción de un rayo de luz- la intermitencia, el carácter cinematográfico del fenómeno.
Visto que todos los fenómenos sólo son intercambios cíe energía, el cuanto elemental está presente en todos los acontecimientos físicos. Esta universalidad es la que da inmenso alcance al descubrimiento de Planck.
En los razonamientos del físico alemán el cuanto era un ente teórico, inventado para resolver las dificultades de un problema especial, pero ALBERT EINSTEIN lo aplicó en 1905 a la luz para explicar el fenómeno de la fotoelectricidad, y ARTHUR COMPTON puso experimentalmente, en 1922, fuera de duda la realidad física del cuanto.
Pero en el intervalo entre estos dos éxitos, un joven dinamarqués, NIELS BOHR (1885-1962), realizó la hazaña decisiva: reunió la teoría cuántica de PLANCK con el modelo atómico de RUTHERFORD.
"Si los electrones que circulan en los átomos -declaró BOHR en 1913- no satisfacen las leyes de la electrodinámica clásica, es porque obedecen a las leyes de la mecánica cuántica.
Sin duda, giran en torno del núcleo atómico, pero circulan únicamente sobre órbitas tales que sus impulsos resultan determinados por múltiplos enteros de la constante de PLANCK.
Los electrones no radian durante todo el tiempo en que describen sus órbitas; solamente cuando el electrón salta de una órbita a otra, más cercana del núcleo, lanza un cuanto de luz, un fotón."
Emitidos por los átomos de gases incandescentes, son los fotones los que engendran las rayas espectrales, y BOHR tuvo el portentoso acierto de poder explicar las rayas del hidrógeno.
En efecto, las longitudes de onda de estas líneas espectrales se vuelven calculables a partir del modelo de átomo cuantificado por BOHR, que interpreta también el origen de los espectros elementales engendrados por los rayos X, espectros cuya importancia acababa de ser puesta en evidencia por el joven físico inglés HENRY GWYN JEFFREYS MOSELEY (1887-1915).
Para dar más clara cuenta de algunas particularidades de los espectros el físico alemán ARNOLD SOMMERFELD (1868-1951) reemplazó en el modelo de BOHR las trayectorias circulares de los electrones por órbitas elípticas, sometiendo además los electrones a la mecánica relativista.
Dos holandeses, SAMUEL GOUDSMIT (1902) y GEORGE UHLENBECK (1900), en 1952 dotaron de movimiento rotatorio al electrón, introduciendo una nueva característica, el "spin", que poseen las partículas y cuya importancia no es menor que la de sus masas o de sus cargas.
Esta nueva magnitud, numéricamente ligada a la constante de PLANCK, da cuenta no sólo de las propiedades magnéticas de los corpúsculos atómicos, sino también del comportamiento que ponen en evidencia cuando integran un conjunto numeroso de partículas.
 Como el modelo atómico de RUTHERFORD, también el de BOHR (imagen izq.) se asemejaba pues a un minúsculo sistema planetario, pero con la esencial diferencia de que en el átomo bohrianolos electrones sólo podían circular sobre trayectorias cuantificadas, como si una misteriosa policía microcósmica les hubiese prohibido las demás.
Como el modelo atómico de RUTHERFORD, también el de BOHR (imagen izq.) se asemejaba pues a un minúsculo sistema planetario, pero con la esencial diferencia de que en el átomo bohrianolos electrones sólo podían circular sobre trayectorias cuantificadas, como si una misteriosa policía microcósmica les hubiese prohibido las demás.
¿Por qué un electrón puede solamente mantenerse sobre una trayectoria permitida por la constante de PLANCK BOHR había dejado la interrogante sin respuesta. Fue el teórico francés LOUIS DE BROGLIE (1892-1987) quien dio en 1923 la contestación.
Cada electrón, explicó DE BROGLIE, va acompañado por un tren de ondas y circula sólo en órbitas de tamaño tal que el tren de ondas pueda caber en ellas, es decir, pueda cerrarse. Si no se cerrara, las ondas sucesivas se neutralizarían, destruyéndose.
Por ello, la circunferencia de una órbita tiene que ser un múltiplo entero de la longitud de la onda que acompaña al electrón.
Ahora bien, DE BROGLIE muestra que las únicas órbita compatibles con las aludidas ondas estacionarias son idéntica con las órbitas cuantificadas de los electrones en el modelo de BOHR.
Viene a ser éste un admirable descubrimiento que explica por qué, en el interior del átomo, ciertas trayectorias son "permitidas" mientras que otras "permanecen prohibidas".
 Asociar al movimiento del electrón -corpúsculo material- una onda; ligar indisolublemente lo discontinuo con lo continuo, es la gran idea que surge de la mecánica ondulatoria de DE BROGLIE, a la cual el austríaco ERWIN SCHRODINGER (1887-1961) -imagen izq. - y el inglés PAUL DIRAC (1902-1983) iban a dar andamiaje matemático y base más amplia.
Asociar al movimiento del electrón -corpúsculo material- una onda; ligar indisolublemente lo discontinuo con lo continuo, es la gran idea que surge de la mecánica ondulatoria de DE BROGLIE, a la cual el austríaco ERWIN SCHRODINGER (1887-1961) -imagen izq. - y el inglés PAUL DIRAC (1902-1983) iban a dar andamiaje matemático y base más amplia.
Ya antes, en la teoría ondulatoria de la luz, que sirvió fielmente a la física durante el siglo XIX, se había introducido el cuanto luminoso o fotón corpuscular; la onda era indispensable para explicar algunos fenómenos; el corpúsculo, no menos imprescindible para explicar otros.
A esta doble imagen de la luz se agregó, con DE BROGLIE (imagen der.) , la doble imagen de la materia, cuyos corpúsculos intraatómicos están inseparablemente ligados a las ondas.
La onda dirige y pilotea los corpúsculos, y éstos materializan las ondas.
Ambas son dos caras complementarias de la realidad y representan la doble faz del mundo físico.
En efecto, la realidad de las ondas de la materia no dejó ya lugar a dudas: CLINTON J. DAVISSON (1881-1958) y LESTER H. GERMER (1896) lograron demostrar en 1927 que un haz de luz de corpúsculos electrónicos se difracciona de la misma manera como lo hace un haz de luz o de rayos X.
Con este veredicto de la experiencia desapareció la clásica diferencia entre luz y materia, tan distintas en la imagen que el siglo pasado se forjaba del mundo físico como son vida y muerte en el mundo biológico.
Enlaces de Interes:
Principales Cambios Científicos
Gran experimento La Máquina de Dios
Las Nuevas Ciencias De Lo Diminuto
La Historia de la Energía Nuclear
La Ciencia AtómicaEn el Siglo XX
Las radiaciones del núcleo atómico, alfa , beta y gamma
Enlace Externo:• Qué es Cuántico? » Su Definición y Significado





