Explicacion de las leyes de la Termodinamica, Descripciòn Sin Formulas
BREVE EXPLICACIÓN SIN FORMULAS DE LAS LEYES DE LA TERMODINÁMICA
La termodinámica es el estudio del calor y de la temperatura. El calor es una forma de energía y la temperatura es la medida de la energía interna de una sustancia.
El principio de la conservación de la energía es fundamental en el estudio de la termodinámica.
Fue desarrollada a finales del siglo XIX por doce científicos, entre ellos James Joule (1818-89), el dueño de una fábrica de cerveza del norte de Inglaterra, y Hermán von Helmholz (1821-94), un fisiólogo alemán.
Aunque, al parecer, existían suficientes pruebas de que la energía no se conservaba, esta teoría finalmente se pudo establecer.
Una de las leyes fundamentales de la física es que no se puede obtener algo de la nada.
Por ejemplo, el motor de un coche no funciona ni el depósito del combustible está vacío. Antes de que el motor pueda suministrar energía mecánica al coche, es preciso que le demos, como mínimo, la misma cantidad de energía en forma diferente, por ejemplo, la energía química del combustible.
Pero la ley también afirma lo contrario: no se puede transformar algo en nada.
Si la mezcla de gas combustible y aire se quema en los cilindros del motor, es imposible que no salga ningún tipo de energía del motor.
No toda la energía que sale de éste es de la oíase que nosotros deseamos, es decir, energía mecánica para mover el coche, sino que la mayor parte se transforma en calor, con lo que se desperdicia.
Pero, ya sea energía perdida en forma de calor o energía mecánica útil, la cantidad total de energía es exactamente la misma que la liberada por el combustible.
En ningún caso se puede perder algo de energía.
Esta ley se conoce como ley de la conservación de la energía, y afirma que la energía no se puede crear ni destruir.
Asimismo, es parte intrínseca de la primera ley de la termodinámica.
La termodinámica es una rama de la física que trata, entre otras cosas, del transporte del calor de un lugar a otro, y de la conversión de la energía calorífica en otras formas de ella.
Además de afirmar que la energía se conserva, la primera ley define la energía calorífica y la energía mecánica.
Parece obvio afirmar que la energía mecánica es la clase de energía ligada al movimiento que posee cualquier objeto que se mueve, mientras que la energía calorífica es algo que hace que los cuerpos estén más calientes.
Sin embargo, a menudo, la distinción entre estos dos tipos de energía no es tan clara y terminante.
En el cilindro de un motor de combustión interna, por ejemplo, la mezcla de los gases se comprime o expande, según los pistones suban o bajen en el interior del cilindro.
La mezcla gaseosa entra en ignición cuando su volumen es mínimo, es decir, en el instante en que se completa su compresión.
En ese momento, la energía calorífica procedente de la reacción química se comunica al gas.
Ejemplo de Transformación de Energía Calorífica en Energía Mecánica
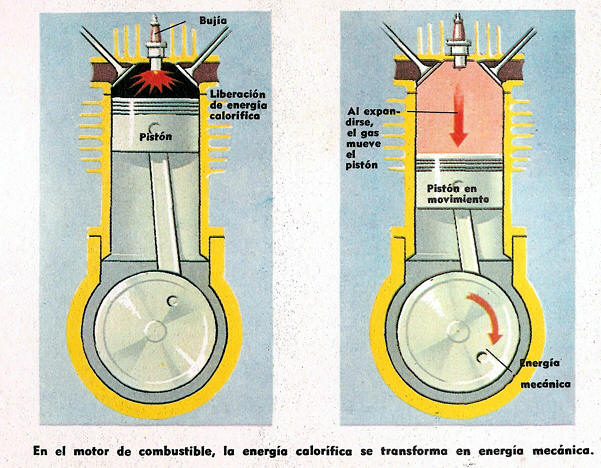
Un gas calentado se expande siempre que tenga oportunidad para ello.
Debido a que su energía ha aumentado, las moléculas empujan contra todas partes, tratando de separarse, y, al hacerlo, actúan sobre el pistón forzándolo a moverse.
Se dice que el gas trabaja contra el pistón y, a medida qué ello ocurre, parte de su energía calorífica primitiva se transforma en energía mecánica, que llega a las ruedas por intermedio de un complejo mecanismo.
La energía que resulta de la expansión y el trabajo realizado es la energía mecánica.
Pero los gases están siempre más calientes que antes de la explosión, esto es, retienen siempre cierta cantidad de energía.
Este otro tipo de energía se denomina energía calorífica interna.
La primera ley de la termodinámica afirma que la energía interna, junto con la energía mecánica, es igual a la energía calorífica suministrada a los gases inicialmente.
La termodinámica nunca trata el movimiento de las partículas aisladas que forman la materia considerada (en nuestro caso, las moléculas del gas). Esta ciencia trata sólo del comportamiento del gas en conjunto.
Es fácil para la termodinámica manejar cantidades tales como la presión, temperatura y volumen de un número relativamente grande de moléculas, cuando todas ellas se comportan, más o menos, del mismo modo.
Pero, aunque la termodinámica nunca se preocupa de las moléculas aisladas, la energía interna y la energía mecánica tienen su significado cuando se aplican a las propias moléculas.
La vibración de las moléculas se debe a la energía interna y, cuanto más caliente está una molécula, más vibra.
La energía que aumenta la velocidad de las moléculas y hace que el gas, en conjunto, se expanda es la forma de energía que se puede convertir en energía mecánica.
LA SEGUNDA LEY DE LA TERMODINÁMICA
Si se ponen en contacto un recipiente de agua hirviendo y un plato con hielo, el agua se enfría y el hielo se calienta.
Hay un intercambio de calor entre el agua hirviendo y el hielo, y pasa más calor del agua al hielo que del hielo al agua.
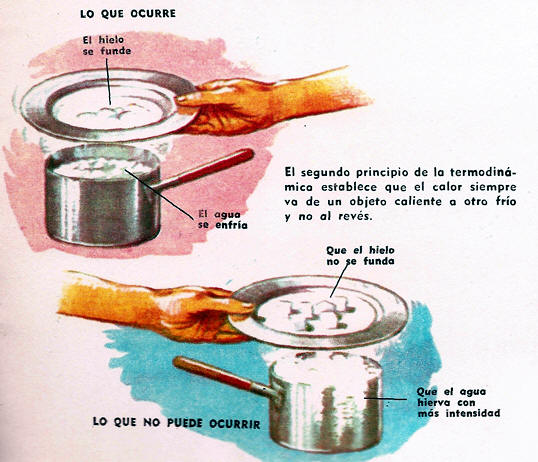
Es decir: el calor siempre va "cuesta abajo", desde el objeto más caliente al objeto más frío.
No es posible que el calor vaya "cuesta arriba" por sí mismo; por ejemplo, de un objeto frío a otro caliente. E
sta afirmación es una de las muchas maneras de enunciar el segundo principio de la termodinámica.
La termodinámica es una rama de la física, que se ocupa de las cantidades de calor que van de un lugar a otro, y de la transformación de la energía calorífica en otras formas de energía.
El principio (ley) cero de la termodinámica define la significación de la temperatura.
El primer principio establece que si tenemos una cierta cantidad de calor, podemos convertirla en otra forma de energía; pero, hagamos lo .que hagamos, no podemos conseguir que desaparezca.
Cuando en dos objetos a distinta temperatura existe una cierta cantidad de energía, el segundo principio rige la dirección del flujo de energía calorífica de un objeto a otro.
La termodinámica abarca, fundamentalmente, una serie de desarrollos matemáticos, y existen muchas otras maneras matemáticas de definir el segundo principio de la termodinámica.
Sin embargo, todas ellas se resumen, diciendo, simplemente, que es imposible que el calor, por sí solo, vaya "cuesta arriba".
En un refrigerador doméstico se hace que el calor vaya "cuesta arriba".
Para ello, debe absorberse calor del congelador, que es el lugar más frío del refrigerador.
Se extrae de un lugar frío y se cede a un lugar más caliente: el aire que rodea al refrigerador.
Pero el calor no puede hacer esto por sí solo.
En muchos de ellos (los de compresor), el movimiento "cuesta arriba" del calor, del objeto frío al caliente, es ayudado por un motor eléctrico, mientras que el calor en sí es transportado por el vapor, en tubos.
Por lo tanto, se usa energía (por el motor) para transferir el calor. Se hace que el vapor se condense, y entonces se lo expansiona bruscamente.
Al expansionarse, se enfría hasta que su temperatura queda por debajo de la parte más helada del congelador.
Solamente así se puede extraer calor de éste, pues, de acuerdo con el segundo principio, el calor sólo puede pasar a un objeto más frío.
Después, el motor comprime el gas, su temperatura sube nuevamente, y de esta forma puede ceder su calor al aire exterior.
Luego, el gas se expansiona, se enfría, y todo el ciclo se repite continuamente.
Sería mucho más fácil fabricar refrigeradores, si el segundo principio de la termodinámica fuese falso.
Si, por ejemplo, el calor pudiese ir, por sí solo, desde el plato con hielo al recipiente de agua hirviendo, el hielo se enfriaría más y el agua herviría con mayor intensidad.
El calor extraído al hielo podría aprovecharse para hervir el agua.
Los refrigeradores no necesitarían motores ni circulación de líquidos. Desgraciadamente, esto no ocurre, y esa imposibilidad es la mejor prueba en apoyo del segundo principio de la termodinámica.
LA TERCERA LEY DE LA TERMODINÁMICA
A Fahrenheit no le gustaba la idea de tener que operar con temperaturas negativas.
Por eso, al idear su escala de temperaturas, quiso asegurarse de que nunca encontraría una temperatura negativa.
Fijó como punto cero de la escala, 0°F, la temperatura de la sustancia más fría entonces conocida, una mezcla frigorífica de hielo y sal.
Sin embargo, hace tiempo que esta ventaja en la escala Fahrenheit ha desaparecido.
Se han desarrollado métodos que permiten alcanzar temperaturas mucho más bajas, que son temperaturas negativas en la escala Fahrenheit.
El método principal consiste en enfriar un gas, comprimirlo y luego dejarlo expandir de repente.
En estas condiciones, muchos gases se enfrían considerablemente.
Por medio de algunos sólidos, todavía pueden alcanzarse temperaturas más bajas, enfriándolos mientras se encuentran en un fuerte campo magnético.
Cuando se suprime el campo, la temperatura del sólido desciende aún más.
Hay, sin embargo, un límite perfectamente definido para el enfriamiento alcanzado en estos procesos.
Existe un cero natural de temperatura, el cero absoluto, que es definitivamente la temperatura más baja posible.
Mientras que la "temperatura más fría posible" de Fahrenheit no duró mucho tiempo como tal, en cambio no hay probabilidad alguna de alcanzar nada más frío que el cero absoluto.
Parecía evidente a los científicos, al observar el comportamiento de los gases sometidos a enfriamiento, que debía existir un cero absoluto.
En efecto, comprimieron los gases enfriados.
Se midió la velocidad de compresión y se llegó a la conclusión de que, si pudiera continuarse el enfriamiento por debajo de —460°F (—273° en la escala centígrada), el volumen del gas habría quedado reducido a nada. ¡Evidentemente, sería imposible lograr un gas más frío que el cero absoluto, donde ocuparía un espacio negativo!
Si bien se reconoció como cosa imposible alcanzar una temperatura más baja que el cero absoluto, persistía todavía el problema:
¿Era incluso posible alcanzar el cero absoluto mismo?
Y aunque actualmente los científicos están a unas cuantas millonésimas de grado de alcanzarlo, es bien sabido que, realmente, jamás lograrán conseguirlo.
Esta afirmación es una de las maneras de enunciar la tercera ley de la termodinámica: "Por mucho que tratemos de enfriar una cosa, es imposible enfriarla por debajo del cero absoluto."
Los científicos han constatado que cuanto más fría está una sustancia, tanto más difícil es conseguir nuevos enfriamientos.
Aislar la sustancia y protegerla del calor del laboratorio es prácticamente imposible.
Las sustancias a bajas temperaturas, invariablemente, se guardan en recipientes de vacío especialmente diseñados.
Pero no es ésta la razón principal de que no pueda alcanzarse la mínima temperatura posible.
El único método de enfriamiento adecuado es, por consiguiente, aquél en que se enfría una clase especial de cristal hasta pocos grados del cero absoluto, con helio líquido.
Al mismo tiempo, el cristal se mantiene en el campo magnético de un grande y potente electroimán.
El helio líquido se quita, el cristal se aísla por completo y el campo magnético se desconecta lentamente.
Tienen lugar cambios en la manera en que los átomos están dispuestos en el cristal, y el resultado es un descenso de la temperatura.
Teóricamente, entonces sería posible usar este cristal enfriado para, a su vez, enfriar otro cristal, y repetir el proceso de magnetización y desmagnetización sucesivamente, llegando cada vez más cerca del cero absoluto.
Desgraciadamente, sucede que, al bajar la temperatura, este descenso se vuelve cada vez más pequeño, de forma que para un cristal de temperatura muy cercana al cero absoluto, el descenso de ésta llega a ser infinitamente pequeño.
Por muchas veces que los cristales sean sucesivamente enfriados, los descensos de temperatura son tan minúsculos, que el cristal nunca alcanzará el cero absoluto.
ENTROPÍA:
La entropía es un parámetro usado en la mecánica estadística para describir el desorden o caos de un sistema.
Un estado de gran desorden es aquel, en el cual las moléculas se agitan al azar en todas las direcciones, con muchas velocidades diferentes.
Una definición alternativa de la segunda ley de la termodinámica es que la entropía del universo nunca disminuye.
De esta definición se desprende que el universo va hacia el equilibrio térmico por medio de un desorden creciente. Por lo tanto, el universo no puede haber existido siempre, sino ya habría llegado a dicho estado de equilibrio.
CALOR LATENTE:
Cuando se transmite calor de un cuerpo a sus alrededores, generalmente varían su temperatura y sus energías internas.
Esto no ocurre, cuando el cuerpo cambia de forma, por ejemplo de sólido a líquido o de líquido a gas.
Este fenómeno se denomina cambio de estado y sólo hace variar la energía interna de un cuerpo.
La cantidad de calor que se necesita para provocar un cambio de estado se denomina calor escondido o latente.
Para convertir agua a 100°C (212°F) a vapor de agua se requiere casi siete veces más calor (calor latente de vaporización) que para el cambio de hielo a agua (calor latente de fusión).
Esto varía para diferentes temperaturas de agua: se necesita más calor para cambiarlo a vapor de agua a 80°C (176°F) y menos a 110°C (230°F).
En cada caso las fuerzas de atracción que enlazan las moléculas de agua se tienen que soltar o romper.
El calor latente tiene un efecto importante sobre el clima. Un ciclo similar tiene lugar en una bomba de calor o en una nevera.
Fuente Consultada: Revista TECNIRAMA Nª 78.






