Gay Lussac:Vida y Obra Cientifica-Ley de los Volúmenes de los Gases
Gay Lussac Vida y Obra Científica - Ley de los Gases
ÁTOMOS Y MOLÉCULAS: Hasta la aparición de los trabajos de Antoine Lavoisier, la química estaba totalmente dominada por la teoría del flogisto.
Los experimentos de Lavoisier transformaron la alquimia en química: una ciencia cuantitativa. John Dalton, en su "Nuevo sistema de la filosofía química" (1808), estableció la "Ley de las proporciones definidas" y la "Ley de las proporciones múltiples".
Dalton pensó que los átomos de cada elemento tenían un peso atómico característico y que los átomos formaban las unidades que entraban a tomar parte en las reacciones químicas.
Pero Dalton no disponía de un método inequívoco de asignar pesos atómicos, y supuso erróneamente que los compuestos más sencillos que pueden formar dos elementos estaban constituidos de dos átomos, uno de cada elemento.
En este sistema, la fórmula del agua se escribirá HO y la del amoníaco NH.
En esa época, Gay-Lussac enunció su ley, en la que se estableció que los volúmenes de las sustancias que forman parte de una reacción y la de los productos resultantes, siempre que todos ellos sean gaseosos, están en la relación de los números enteros y sencillos.
Hasta 1860 sin embargo, no se aclararon totalmente los conceptos de átomo y molécula, a pesar de que la ley que condujo a ello había sido anunciada por Avogadro en 1811.
Esta ley, que decía que a igualdad de temperatura y presión, un mismo volumen de cualquier gas contenía el mismo número de moléculas, deshizo los errores aceptados hasta esa época, al establecer que una molécula podía estar formada por átomos iguales.
Los trabajos de Avogadro fueron injustamente olvidados hasta la conferencia de Karlsruhe en 1860.
La razón de este desprecio fue la creencia, profundamente enraizada en las mentes más significativas de la época, de que las combinaciones químicas ocurrían en virtud de una cierta afinidad entre elementos distintos.
Con los descubrimientos de Volta y Galvani, esta afinidad fue asignada a atracciones de tipo eléctrico.
La idea de que dos átomos de hidrógeno pudieran combinarse para formar una molécula H2 repugnaba a los químicos de principios del siglo XIX.
OBRA CIENTÍFICA DE GAY LUSSAC:
José Luís Gay-Lussac es conocido, sobre todo, por haber establecido la ley de los volúmenes gaseosos. Probablemente, esto se debe a que esa ley aún lleva su nombre: Ley de Gay-Lussac.
Este célebre científico dijo que cuando los gases se combinan, sus volúmenes mantienen entre sí una relación simple, si sus temperaturas y presiones son constantes.
Estos volúmenes también mantienen una relación simple con los volúmenes de los productos formados, si estos productos son gases.
Si los productos formados son sólidos o líquidos, esto último no es aplicable.
Por ejemplo: 2 cm3 de hidrógeno se combinan explosivamente con 1 cm3 de oxígeno para formar 2 cm3 de vapor de agua. Estas relaciones entre volúmenes son sencillas.
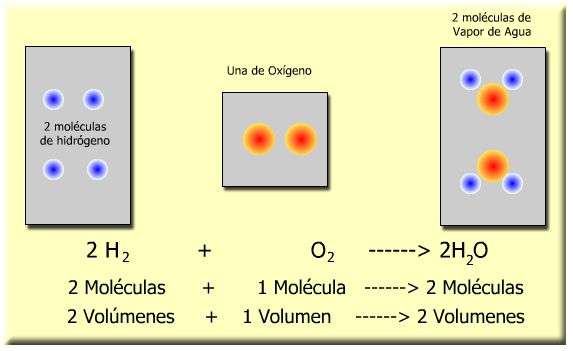
No ha quedado nada de hidrógeno ni de oxígeno.
Pero, cuando el vapor se condensa para formar agua, ocupa un volumen menor.
Esto fue sólo una pequeña parte del trabajo de Gay-Lussac, pues tuvo una mente muy activa y, junto a sus descubrimientos en el campo de la física, contribuyó a otros, en la química y en la industria química.
------------- 00000 ------------
 Gay-Lussac nació en St. Leonard, un pueblo pequeño situado al sur de Francia, y a la edad de 19 años ingresó en la Escuela Politécnica de París. Al salir de ésta, en 1801, comenzó a trabajar en el Departamento de Caminos y Puentes.
Gay-Lussac nació en St. Leonard, un pueblo pequeño situado al sur de Francia, y a la edad de 19 años ingresó en la Escuela Politécnica de París. Al salir de ésta, en 1801, comenzó a trabajar en el Departamento de Caminos y Puentes.
Inició sus investigaciones cuando fue elegido por Berthollet para trabajar como asistente suyo en los establecimientos químicos del gobierno, en Arceuil.
------------- 00000 ------------
En 1802, como resultado de sus experimentos con gases, expuso la idea de que todos los gases se dilatan al mismo volumen si se eleva su temperatura en la misma cantidad.
Esta idea fue simultáneamente expresada por J. Charles, que trabajaba independientemente.
Gay-Lussac también efectuó experimentos para encontrar el coeficiente de dilatación de los gases.
Este coeficiente es el volumen hasta el que se dilataría un centímetro cúbico de gas, si su temperatura aumentara un grado centígrado.
El valor que encontró es algo mayor que el valor que ahora se acepta.
Después se interesó en el estudio de los vapores, y realizó experimentos para hallar las densidades de algunos de ellos.
Al efectuar estos trabajos, se dio cuenta de que el diseño de termómetros y barómetros distaba de ser perfecto, y consagró parte de su tiempo a introducir mejoras en ellos.
Gay-Lussac se preguntaba cómo cambiaría la composición de'la atmósfera con la distancia a la Tierra.
¿Cómo serían afectadas las temperaturas? ¿Cómo se comportaría los imanes?.
Tales preguntas lo indujeron a hacer dos ascensiones en globo, para investigar estos problemas.
La segunda de estas ascensiones la realizó solo.
Junto con Humboldt, analizó una muestra de aire bajada desde 7.500 metros. Gay-Lussac y Humboldt, conjuntamente, descubrieron que dos volúmenes de hidrógeno se combinan con uno de oxígeno para formar agua.
Este resultado hizo que Gay-Lussac se preguntase si otros gases reaccionarían de un modo análogo.
En 1808 había reunido suficiente evidencia para demostrar que efectivamente era así.
Los gases se combinaban en relaciones de volúmenes sencillas; si los productos de reacción eran gases, sus volúmenes también se encontraban en una relación sencilla con los de los productos reaccionantes.
Un centímetro cúbico de nitrógeno se combinaría exactamente con 3 cm3 de hidrógeno para formar 2 cm3 de gas de amoníaco. Gay-Lussac anunció su ley en 1808.
En 1809 fue nombrado profesor de química de la Escuela Politécnica de París (donde él había sido estudiante) y, además, profesor de química del Jardín Botánico.
Desde entonces realizó la mayor parte de sus trabajos de investigación en el campo de la química. Estos trabajos cubrieron muchísimos temas.
Probablemente, su contribución más importante fue la que hizo a la industria. Los óxidos de nitrógeno se usan como catalizadores en la fabricación de ácido sulfúrico por el procedimiento de la cámara de plomo. Estos óxidos aceleran la reacción de conversión del bióxido de azufre en trióxido de azufre, el cual se disuelve en agua formando ácido sulfúrico.
Los óxidos de nitrógeno se pueden usar de nuevo, pero en aquel entonces no existía ningún método efectivo para recuperarlos.
La primera torre de Gay-Lussac, para su recuperación, fue empleada en 1842.
Aún hoy se usan torres análogas para la misma finalidad.
Gay Lussac murió en Paris, el 9 de Mayo de 1850, a la edad de 72 años.
Fuente Consultada:
150 Grandes Científicos Norman J. Bridge (TEXIDO)
Enciclopedia TECNIRAMA De la Ciencia y la Tecnología N°44 Gay Lussac
Temas Relacionados:
Los gases nobles Gases Inertes Argon Neon Helio
Los Gases Nobles: Propiedades ,Aplicaciones y Concepto de Gas
Teoría Cinética de los Gases Ideales
Leyes de los Gases Ideales Ley de Boyle, Lussac y Ecuacion
El Humo: Gases de Combustión, Características y Concepto
Gas Natural Clasificación, Distribución, Transporte
Enlace Externo:• Biografía de Louis Joseph Gay - Lussac






