Los Gases Nobles o Inertes :Concepto,Propiedades y Aplicaciones
Los Gases Nobles o Inertes:Propiedades,Aplicaciones y Concepto
¿Qué tienen de noble los gases nobles?
Los elementos que reaccionan difícilmente o que no reaccionan en absoluto con otros elementos se denominan «inertes».
El nitrógeno y el platino son ejemplos de elementos inertes.
En la última década del siglo pasado se descubrieron en la atmósfera una serie de gases que no parecían intervenir en ninguna reacción química.
Estos nuevos gases —helio, neón, argón, criptón, xenón y radón— son más inertes que cualquier otro elemento y se agrupan bajo el nombre de «gases inertes».
Los elementos inertes reciben a veces el calificativo de «nobles» porque esa resistencia a reaccionar con otros elementos recordaba un poco a la altanería de la aristocracia.
El oro y el platino son ejemplo de «metales nobles», y por la misma razón se llamaba a veces «gases nobles» a los gases inertes.
Hasta 1962 el nombre más común era el de «gases inertes», quizá porque lo de nobles parecía poco apropiado en sociedades democráticas.
La razón de que los gases inertes sean inertes es que el conjunto de electrones de cada uno de sus átomos está distribuido en capas especialmente estables.
La más exterior, en concreto, tiene ocho electrones.
Así la distribución electrónica del neón es (2, 8) y la del argón (2, 8, 8).
Como la adición o sustracción de electrones rompe esta distribución estable, no pueden producirse cambios electrónicos.
Lo cual significa que no se pueden producir reacciones químicas y que esos elementos son inertes.
Ahora bien, el grado de inercia depende de la fuerza con que el núcleo, cargado positivamente y situado en el centro del átomo, sujeta a los ocho electrones de la capa exterior.
Cuantas más capas electrónicas haya entre la exterior y el centro, más débil será la atracción del núcleo central.
Quiere esto decir que el gas inerte más complejo es también el menos inerte. El gas inerte de estructura atómica más complicada es el radón.
Sus átomos tienen una distribución electrónica de (2, 8, 18, 32, 18, 8).
El radón, sin embargo, está sólo constituido por, isótopos radiactivos y es un elemento con el que difícilmente se pueden hacer experimentos químicos.
El siguiente en orden de complejidad es el xenón, que es estable. Sus átomos tienen una distribución electrónica de (2, 8, 18, 18, 8).
Los electrones más exteriores de los átomos de xenón y radón están bastante alejados del núcleo y, por consiguiente, muy sueltos.
En presencia de átomos que tienen una gran apetencia de electrones, son cedidos rápidamente.
El átomo con mayor apetencia de electrones es el flúor, y así fue como en 1962 el químico canadiense Neil Bartlett consiguió formar compuestos de xenón y flúor.
Desde entonces se ha conseguido formar también compuestos de radón y criptón.
Por eso los químicos rehuyen el nombre de «gases inertes», porque, a fin de cuentas, esos átomos no son completamente inertes.
Hoy día se ha impuesto la denominación de «gases nobles» y existe toda una rama de la química que se ocupa de los «compuestos de gases nobles».
Naturalmente, cuanto más pequeño es el átomo de un gas noble, más inerte es, y. no se ha encontrado nada que sea capaz de arrancarles algún electrón.
El argón, cuya distribución electrónica es (2, 8, 8), y el neón, con (2, 8), siguen siendo completamente inertes.
Y el más inerte de todos es el helio, cuyos átomos contienen una sola capa electrónica con dos electrones (que es lo máximo que puede alojar esa primera capa).
Fuente Consultada: Cien Preguntas Sobre La Ciencia de Isaac Asimov
------------- 00000 ------------
Concepto y Propiedades de Los Gases Nobles o Inertes
CONCEPTO:
El gas es un estado de la materia en el que ésta llena por completo el recinto que la contiene, sea grande o pequeño, pues los cuerpos en este estado carecen de forma y volumen propios.
Esta definición, puramente fenomenológica, era la corriente hasta el establecimiento definitivo de la teoría cinética de la materia, que explica el estado gaseoso por liberación de la acción atractiva que ejercen entre sí las masas de las moléculas y por la energía cinética comunicada a éstas por el calor.
En el estado gaseoso, las moléculas se mueven libremente en el recinto que las contiene, rebotando contra sus paredes o chocando entre sí continuamente.
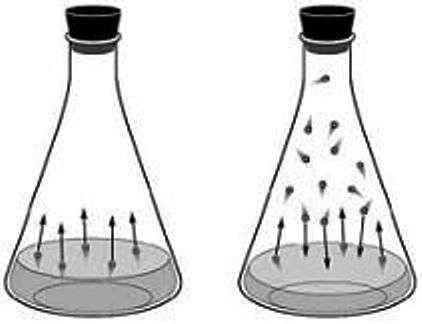
Los gases son fácilmente solubles en algunos líquidos, y la cantidad disuelta es proporcional a la presión; actúan como malos conductores del calor y la electricidad, y generalmente son transparentes y de color débil.
El que un cuerpo se encuentre o no en estado gaseoso depende de la temperatura y la presión a que está sometido, pues todos los gases, al aumentar la presión o disminuir la temperatura, se pueden licuar.
Los gases perfectos se dilatan, a presión constante, y aumentan su volumen 1/273 veces por cada grado centígrado que asciende la temperatura.
Los dos gases más comunes en la naturaleza son el oxígeno y el nitrógeno, principales componentes del aire.
Por definición:
GASES NOBLES: Conjunto de los elementos gaseosos que constituyen el grupo VIII A u O de la tabla periódica de los elementos (helio, argón, neón, criptón, xenón y radón). No presentan tendencia a combinarse con otros elementos.
LOS GASES NOBLES:
Existe una familia de elementos inertes, indiferentes a los reactivos y hasta incapaces de formar moléculas que aglomeran sus propios átomos: son el argón, el criptón, el helio, el neón, el radón y el xenón.
El motivo de su inactividad o indolencia química reside en que el cortejo de electrones de su capa periférica está completo (2, 8 ó 18 según el caso).
En otras palabras, no existe razón alguna para que tiendan a capturar electrones ajenos o a ceder los suyos propios.
LAS CAUSAS DE LA REACTIVIDAD
Los seis elementos que acabamos de ver son gases, a pesar de que el peso atómico de algunos es extremadamente elevado, porque casi ninguna fuerza vincula sus moléculas.
En cambio, los demás elementos son más o menos activos porque la estructura de su átomo carece de una distribución ideal de los electrones periféricos; éstos pueden hallarse en exceso —como en el flúor y en el cloro—, o ser insuficientes con respecto al número-tipo capaz de asegurar su equilibrio.
De aquí su tendencia a unirse entre sí, o con otros elementos complementarios, para compensar su inestabilidad.
Con reactivos sumamente ávidos y enérgicos se logra, venciendo grandes dificultades, sintetizar algunos compuestos de xenón "y otros gases nobles. Pero la inercia química sigue siendo la característica distintiva de estos elementos.
Recordemos que los átomos de todos los elementos sin excepción, son eléctricamente neutros, porque el número de protones del núcleo iguala al de electrones que giran en sus distintas órbitas.
La reactividad química se debe exclusivamente a la necesidad de completar el número ideal de electrones de la capa periférica, por razones de equilibrio atómico, no de carga eléctrica.
• ARGÓN
Peso atómico 39,944; 18 electrones en órbita. Única fuente comercial: la atmósfera; vestigios en minerales y meteoritos.
Su utilización principal son las lamparillas eléctricas: no reacciona con el tungsteno incandescente, y sus moléculas detienen las partículas que éste proyecta, evitando que ennegrezcan el vidrio.
En la actualidad, la soldadura con arco eléctrico y las operaciones metalúrgicas con titanio y otros metales ávidos de oxígeno, consumen más argón que la industria de fabricación de lámparas.
También se lo emplea en las válvulas electrónicas de gas (tiratrones), en los contadores Geiger, en las cámaras que miden rayos cósmicos, y como sustituto del helio en ciertos espectrógrafos de masa.
En el laboratorio se emplea en la cromatografía, cuando se trabaja con productos muy reactivos, porque es inerte.
Se deduce fácilmente que la soldadura de arco de metales que arden en el aire requiere una atmósfera neutra. De ahí el éxito del argón envíos trabajos con aluminio, magnesio, titanio, aleaciones de cobre o níquel, y acero inoxidable.
También se lo emplea indistintamente con el helio, en la preparación de cristales de silicio y germanio para transistores, y se lo prefiere por su mayor abundancia.
El argón constituye el 0,9 % del volumen de la atmósfera; su isótopo de peso atómico 40, que probablemente proviene de la desintegración radiactiva del potasio, forma su mayor parte. Se lo obtiene por medio de la licuefacción del aire.
• CRIPTÓN
Peso atómico 83,80; 36 electrones en órbita.
Única fuente comercial: la atmósfera; vestigios en minerales y meteoritos.
Su uso principal son las lámparas flash para fotografía (ya en deshuso) y otros dispositivos electrónicos. Se lo mezcla con argón para llenar los tubos fluorescentes.
Debido a su mayor peso molecular es superior al argón para impedir la evaporación del tunsgteno en las lamparillas eléctricas; pero es escaso y se lo reserva para los proyectores de gran brillo y eficiencia.
Existe un criptón radiactivo de peso 85 que se emplea para la medición del espesor de las láminas de metales y plásticos, y en lámparas que dan luz durante varios años, sin otra fuente de energía que su radiactividad, que excita una capa fosforescente.
En medicina sirve para revelar defectos cardíacos, porque permanece en el cuerpo solamente durante el escaso tiempo necesario para observar la anomalía.
El criptón constituye sólo 1,14 partes por millón del volumen de la atmósfera. El criptón radiactivo se forma en las explosiones atómicas.
• HELIO
Peso atómico 4,003; 2 electrones en su única órbita.
Su mayor fuente comercial son las reservas de gas natural de los Estados Unidos, que contienen 5 % de helio.
Antiguamente se empleaba en globos y dirigibles, porque no es explosivo como el hidrógeno, y su poder ascensional es el 92 % con relación a éste.
Se lo utiliza todavía en los pequeños globos meteorológicos y en los gigantescos aeróstatos que exploran los rayos cósmicos en la atmósfera superior.
Como él argón, el helio se emplea mucho en la soldadura de metales reactivos.
Es además esencial para obtener fríos extremos, para reemplazar el nitrógeno en la atmósfera que respiran los buzos a grandes profundidades en la terapéutica del asma, porque es mucho más fluido que el nitrógeno que habitualmente acompaña el oxígeno, y, a veces, como diluyeme inerte en la anestesia.
El helio es un refrigerante de los reactores nucleares, porque no se vuelve radiactivo; en los túneles de viento permite obtener datos sobre velocidades extremas; en las cámaras de burbujas revela partículas de elevada energía, y en los cojinetes lubricados a gas se aprovecha su viscosidad minúscula.
El helio constituye 5,24 partes por millón del volumen de la atmósfera. Como la demanda excede enormemente a la producción se lo sustituye por argón, cuando es posible.
• NEÓN
Peso atómico 20,183; 10 electrones en órbita.
Única fuente comercial: la atmósfera; existen también algunos vestigios en minerales y meteoritos.
Cuando se produce una descarga eléctrica en el neón rarefacto, emite una brillante luz rojo-anaranjada.
De ahí su uso en los llamados tubos de neón. Para obtener otros colores se añaden vapor de mercurio y alguno de los demás gases nobles.
El neón es a la vez un conductor para los altos voltajes y un interruptor cuando la tensión es baja; esto explica el uso de válvulas de neón como salvaguardia de ciertos motores eléctricos contra súbitas elevaciones de voltaje.
Se necesita muy poca potencia (vatios) para producir luz en las lámparas de neón; de aquí su uso en la iluminación nocturna contra accidentes.
El neón constituye 18,18 partes por millón del volumen de la atmósfera. No se le conocen isótopos radiactivos.
• RADÓN
Peso atómico 222; 86 electrones en órbita. Es un gas sumamente pesado emitido por el radio, y que, en menos de cuatro días, se reduce a la mitad por desintegración, cuyo producto último es el plomo.
Se lo utiliza en los hospitales para el tratamiento de ciertos tumores.
Como el gel de sílice y otros adsorbentes lo retienen fácilmente, es cómodo purificarlo.
• XENÓN
Peso atómico 131,30; 54 electrones en órbita. Única fuente comercial: la licuefacción del aire, del que sólo constituye 0,086 partes por millón. Se lo emplea en las lámparas flash de alta velocidad, porque produce un color bien equilibrado y puede usarse más de diez mil veces.
En el arco eléctrico (proyectores de cinematógrafo) la intensidad de la luz producida por el xenón es la misma que la del carbono de arco.
Absorbe fácilmente las radiaciones, y después de ello se lo mezcla con el acetileno, al que polimeriza y convierte en otras sustancias.
Es un buen anestésico de efecto fugaz: el paciente sé recupera en menos de dos minutos cuando deja de respirarlo; además puede asociarse sin peligro a otros hipnóticos explosivos como el éter, porque es inerte.
Se lo emplea mucho en física nuclear pues absorbe fácilmente los neutrones; pero aún no se han resuelto sus graves inconvenientes, como el envenenamiento del combustible nuclear, cuyo ritmo de fisión disminuye gradualmente.
ESTABILIDAD IDEAL DE LAS CAPAS DE ELECTRONES EXTERIORES
Primera órbita (helio), 2 electrones.
Segunda órbita (neón), 8 electrones.
Tercera órbita (argón), 8 electrones.
Cuarta órbita (criptón), 18 electrones.
Quinta órbita (xenón), 18 electrones.
Sexta órbita (radón), 32 electrones.
Fuente Consultada:
Revista TECNIRAMA N°17
CONSULTORA Enciclopedia Temática Ilustrada Tomo 10 El Mundo Físico.
Temas Relacionados
Gas de Alumbrado Historia y Obtención del Gas de Hulla
Gas Natural Clasificación, Distribución, Transporte
Historia de la Lampara Electrica
El Negocio del Gas Natural en el Mundo
La Explotacion del Petroleo Busqueda Cientifica y Técnologica
Dilatacion de un Gas a Presion Constante:Leyes y Ejemplos
Enlace Externo: Los Gases Nobles






