Leyes de la Teoría Atómica: Masa Atomica, Mol y Numero de Avogadro
Leyes de la Teoría Atómica: Masa Atomica, Mol y Numero de Avogadro
ELEMENTO Y COMPUESTO QUÍMICO, LEYES FUNDAMENTALES, MASA ATÓMICA, MOL E HIPÓTESIS DE AVOGADRO
Pocas sustancias extraídas de la tierra pueden utilizarse sin elaboración previa. Los 92 elementos puros que las componen se combinan entre sí de diversos modos.
La industria procura separar las sustancias naturales en sus componentes fundamentales y volver a unirlos formando combinaciones más útiles.
La civilización actual sólo fue posible cuando los químicos descubrieron cómo lograrlo.
El montoncito de azufre de abajo representa una de las pocas sustancias halladas en la naturaleza cuyos átomos son de la misma clase. El azufre es un elemento.
Existen 92 de ellos y además hay 11 obtenidos artificialmente.

La enorme mayoría de las sustancias puras son combinaciones de dos o más elementos químicos y reciben el nombre de compuestos.
¿Cómo se unen los elementos entre sí? .
Para poder separar los compuestos en sus elementos y hacerlos combinar nuevamente, los químicos tuvieron que encontrar la respuesta a esta pregunta.
Se ha descubierto que cuando dos elementos químicos se combinan, los átomos de uno se unen a los del otro.
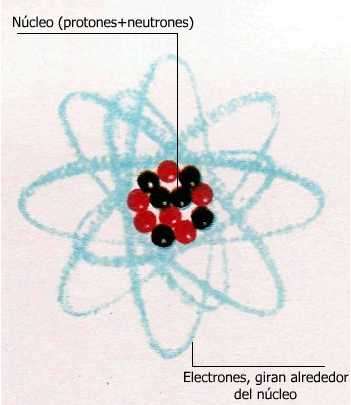
Un átomo, que es la más pequeña porción posible de un elemento, consiste en un núcleo central rodeado por uno o más electrones, sumamente pequeños, que giran a su alrededor como los planetas en torno al Sol.
Los electrones desempeñan un papel esencial en la unión de los átomos. Dos átomos se combinan cuando comparten sus electrones exteriores, que entonces giran alrededor de ambos núcleos.
Se llama molécula a esta combinación de átomos (aunque no es necesario que sean precisamente dos).
Hay "macromoléculas" formadas por muchos átomos, como las de las proteínas, el caucho, los plásticos y las fibras textiles naturales o sintéticas.
En la figura de abajo se muestra un átomo de carbono (medio) y otro de oxígeno.
Se puede hacer que dos átomos de oxígeno compartan sus electrones exteriores con un átomo de carbono.
El resultado de esta combinación es una molécula de bióxido de carbono o anhídrido carbónico. Al combinarse, los átomos pierden por completo sus propiedades distintivas. La molécula es diferente de las dos clases de átomos que la componen.
LAS BASES DE LA TEORÍA ATÓMICA
Juan Dalton marca la génesis de la primera teoría atómica moderna: la idea de un átomo específico para cada elemento químico.
Dalton (1766-1844) fue el primero que fundó sus teorías sobre los resultados de sus experimentos.
En esta época se había llegado a la conclusión de que la materia consistía de varios elementos simples que, al unirse entre sí, formaban sustancias químicas complicadas.

Dalton afirmó que cada elemento consistía de muchos átomos idénticos entre si, pero diferentes de los de los ctros elementos; v que todos los átomos eran indivisibles.
Dalton comprendió que los átomos de los distintos elementos se combinaban entre sí de modo especial. Los compuestos químicos construidos de este modo siempre contienen los mismos átomos en el mismo orden y proporción.
Preparó un "código" en base a símbolos gráficos que utilizaba para representar la fórmula o "receta" por el peso de los diferentes compuestos químicos.
CONCEPTO DE ELEMENTO QUÍMICO, COMPUESTO Y MEZCLA:
Se llama elemento químico a aquella sustancia cuyos átomos son todos de la misma clase (azufre, carbono, oxígeno, litio, calcio, etc.).
Pero esto no es lo común, porque los átomos tienen gran tendencia a unirse entre sí, sea con átomos de la misma naturaleza, sea con átomos diferentes.
Muchos elementos son metales como el oro, pero otros como el azufre o el fósforo no lo son; los hay sólidos, los hay líquidos, los hay gaseosos.
La química estudia a fondo y explica todas estas propiedades.
Los compuestos son sustancias formadas por dos o más elementos diferentes. Estos elementos no están simplemente mezclados; cada átomo de uno de ellos está atado fuertemente a otro o a otros átomos de elementos distintos, de modo que forma otra clase de sustancia.
El agua es un buen ejemplo, porque consiste en dos átomos de hidrógeno unidos a un átomo de oxígeno, de ahí su fórmula H2O.
Y el agua es un líquido a pesar de que el hidrógeno y el oxígeno son gases.
La menor partícula imaginable de un compuesto se llama molécula y siempre contiene exactamente los átomos que le corresponden, en la proporción debida.
Ahora bien, ocurre que no todos los átomos tienen el mismo peso; los hay livianos, los hay pesados.
De allí que cuando descomponemos una combinación de elementos obtenemos relaciones que no siempre son simples, pero que se vuelven muy sencillas cuando tenemos en cuenta los pesos particulares de los átomos.
Lo que debe tenerse bien en cuenta es que una molécula es totalmente distinta de los elementos que contiene y que éstos, al unirse los átomos, pierden sus propiedades individuales, es decir, el comportamiento típico que permite reconocerlos.
Las mezclas son simplemente elementos, o compuestos, o ambos, reunidos, en proporciones cualesquiera. Poseen las propiedades de sus ingredientes y pueden generalmente ser separados por medios muy sencillos.
El barro, p. ej., es una mezcla de tierra y de agua; el aire es una mezcla de nitrógeno y oxígeno.
Las mezclas no son nuevas clases de sustancias.
Introduciendonos mas científicamente en el tema, debemos decir que hay dos leyes fundamentales de la química que rigen las reacciones quimicas entre elementos químicos y sustancias (moléculas), una es la llamada "conservación de la masa" y la otra la "ley de las proporciones definidas" que dicen:
1-Ley de la Conservación de la Masa:
"En todas las reacciones químicas se cumple que la suma de las masas de las sustancias con las que se inicia una reacción química es igual a la suma de las masas de las sustancias que resultan de ella (ley de conservación de la masa para las reacciones químicas)".
2-Ley de las Proporciones Definidas:
"Cuando dos o más elementos químicos se combinan para formar un determinado compuesto, lo hacen según una relación constante entre sus masas".
De esta última también se desprende que: Inversamente, cuando un determinado compuesto se separa en los elementos que lo componen, las masas de estos elementos se encuentran en una relación constante que es independiente de la fuente de procedencia del compuesto o del modo en que haya sido preparado.
Explicación de Ejemplo: Como la "receta química" o fórmula del anhídrido carbónico es CO2, es decir, un átomo de carbono y dos de oxigeno, podríamos pensar que dos terceras partes de su peso son de oxígeno y el tercio restante de carbono, osea aproximadamente 30 gr. de oxígeno y 14 de carbono, pero no es así.
Si descomponemos 44 gr. de anhídrido carbónico obtendremos 32 gr. de oxígeno y solamente 12 de carbono. La explicación consiste en que los distintos átomostienen pesos atómicos diferentes.
El carbono es más liviano que el oxígeno. Prácticamente todo el peso del átomo está concentrado en el núcleo (protones+neutrones).
El núcleo del átomo de hidrógeno (el más liviano) es una partícula simple llamada protón; el núcleo de cualquier otro átomo es una mezcla de dos tipos de partículas: protones y neutrones.
Los pesos de ambas son similares, pero mientras el protón lleva una carga eléctrica positiva, el neutrón no posee carga alguna.
El núcleo de un átomo de oxígeno contiene 8 protones y 8 neutrones o sea 16 partículas, por lo que es 16 veces más pesado que el átomo de hidrógeno.
Como el peso real de cualquier átomo es increíblemente pequeño, se prefiere utilizar una escala de pesos completamente diferente, cuya unidad es el protón.
Así, el átomo de oxígeno con sus 16 partículas pesa 16 unidades.
El carbono posee 12 partículas (12 unidades) en el núcleo: su "peso atómico" es 12.
Se entiende que 16 gramos de oxígeno contendrán el mismo número de átomos que 12 gramos de carbono, puesto que la proporción de los pesos en gramos es la misma que la de los átomos individuales.
Como la fórmula del anhídrido carbónico exige el doble de átomos de oxígeno que de carbono, serán necesarios 2 x 16 — 32 gr. de oxígeno. Combinándolos con los 12 gr. de carbono obtendremos 12 gr. + 32 gr. = 44 gr. de anhídrido carbónico.
Veamos otro ejemplo: El gas llamado bióxido de azufre o anhídrido sulfuroso (SO2), que se produce cuando se quema azufre, es decir, cuando el azufre se combina con el oxígeno.
Su "receta" o fórmula es un átomo de azufre por cada dos átomos de oxígeno, de modo que si queremos producirlo quemando directamente azufre én oxígeno deberemos disponer un átomo o medida de azufre por cada dos de oxígeno.
Ya sabemos que dos medidas de oxígeno equivalen a 32 gr: Como el peso atómico del azufre es 32, una medida de azufre equivaldrá a 32 gr.
El resultado es 32 gr.+ 32 gr. = 64 gr. de anhídrido sulfuroso, de fórmula SO2. Si colocásemos demasiado azufre o demasiado oxígeno, luego del experimento el excedente quedaría sin utilizar.
LEYES DE LA TEORÍA ATÓMICA:
Con lo que hemos visto hasta el momento somos capaces de decidir si una sustancia es un elemento químico, un compuesto químico o una mezcla.
También podemos calcular la cantidad de reactivos que necesitamos combinar para obtener una cierta cantidad de producto. Sin embargo, todavía no disponemos de una teoría que sea capaz de explicar todos estos conocimientos.
Esta teoría, conocida como teoría atómica, fue enunciada, en los primeros años del siglo XIX. por el químico inglés John Dalton, aunque sería modificada posteriormente gracias a las aportaciones del químico italiano Amadeo Avogadro. Sus ideas principales se pueden resumir de la siguiente manera:
a) La materia es discontinua.
Es decir, los cuerpos están formados por partículas independientes llamadas átomos.
b) Existen distintos tipos de átomos.
Un elemento químico es una sustancia formada por un solo tipo de átomos. Los átomos de un determinado elemento químico son iguales entre sí, pero son distintos de los átomos de los restantes elementos.
c) Una molécula es la parte más pequeña de una sustancia pura
(o compuesto) capaz de existencia individual estable. Unas moléculas se diferencian de otras por el número y tipo de los átomos que las forman, así como por la manera en la que dichos átomos están colocados.
Una sustancia pura es una sustancia formada por un solo tipo de moléculas. Dicho de otro modo, las moléculas de una sustancia pura son iguales entre sí. pero son distintas de las moléculas de las restantes sustancias puras.
d) Las moléculas pueden estar formadas por un solo átomo (moléculas monoatómicas), pero lo más frecuente es que estén formadas por dos o más átomos, que pueden ser del mismo o de distinto tipo.
Si las moléculas de una sustancia pura son monoatómicas o contienen átomos del mismo tipo, la sustancia es un elemento químico; en caso contrario, la sustancia es un compuesto.
Un compuesto químico es una sustancia pura cuyas moléculas
están formadas por dos o más tipos de átomos.
LAS REACCIONES QUÍMICAS:
En el transcurso de la reacción, los átomos no se destruyen ni se transforman en átomos de otro elemento, sino que se organizan de un modo diferente.
Tampoco se crean nuevos átomos de la nada; por tanto, la cantidad total de átomos de cada tipo se mantiene constante durante toda la reacción, lo que explica que la masa de las sustancias con las que se inició la reacción sea igual a la masa de las sustancias que se obtienen al final de la misma.
Esto explica la ley de conservación de la masa.
Puesto que todas las moléculas de un compuesto químico son iguales (tienen el mismo número y tipo de átomos dispuestos de la misma manera), la relación entre las masas de los elementos que forman el compuesto siempre será la misma, independientemente de la cantidad de compuesto que se analice.
Esto explica la ley de las proporciones definidas
• ►Fórmulas Químicas:
La Química ha encontrado que es muy conveniente expresar la composición de una sustancia mediante fórmulas.
Las sustancias puras se representan mediante fórmulas:
Las fórmulas se construyen con los símbolos de los elementos que componen la sustancia y con números que indican la cantidad de átomos de cada elemento que hay en cada molécula de dicha sustancia. Por ejemplo:
• La fórmula del sulfato de calcio es CaS04. lo que significa que cada molécula de sulfato de calcio contiene un átomo de calcio, un átomo de azufre y cuatro átomos de oxígeno.
• La fórmula del hidróxido de calcio es Ca(OH)2, lo que significa que una molécula de hidróxido de calcio contiene un átomo de calcio, dos átomos de oxígeno y dos átomos de hidrógeno.
MASAS ATÓMICA Y MOLECULARES:
La masa de los átomos es muy pequeña. Nuestras balanzas no sirven para determinar directamente la masa de un átomo, y las unidades de medida que solemos manejar (kilogramos, gramos, miligramos) son demasiado grandes para que nos sean de utilidad.
¿Cómo es posible averiguar la masa de los átomos y cuáles son las unidades más convenientes para expresarla?
Los químicos miden la masa de los átomos y las moléculas en unidades de masa atómica (u).
Una unidad de masa atómica es aproximadamente igual a la masa de un átomo de hidrógeno. (Hoy en día, la comunidad científica acepta una definición más precisa, aunque la definición anterior es suficiente para nuestros propósitos.)
Si aceptamos que la masa del átomo de hidrógeno es igual a la unidad, cuando decimos que la masa de un átomo de oxígeno es de 16 unidades de masa atómica, lo que en realidad estamos indicando es que la masa del átomo de oxígeno es 16 veces mayor que la masa del átomo de hidrógeno.
Análogamente, si decimos que la masa de una molécula de agua es de 18 unidades de masa atómica, lo que queremos decir es que la masa de una molécula de agua es 18 veces mayor que la masa de un átomo de hidrógeno.
¿Cómo es posible comparar la masa de partículas tan pequeñas como los átomos o las moléculas?.
La clave de esta comparación se encuentra en la hipótesis de Avogadro.
LA LEY DE AVOGADRO:
Dalton no sabía cuántos átomos de los distintos elementos formaban un compuesto en particular. La respuesta, empero, no tardaría en llegar.
En 1811 Amadeo Avogadro, profesor italiano, estableció su importante "ley": "Si colocamos varios gases en recipientes del mismo tamaño, a igual presión y temperatura, todos los recipientes contendrán igual número de partículas de gas".
Esto hace posible, pesando les diferentes gases, comprobar que los átomos de uno tienen peso distinto al de otro.
Conocidos los pesos relativos de los átomos individuales de, digamos, el hidrógeno y el oxígeno, es posible afirmar (usando las recetas de Dalton) que dos átomos de hidrógeno se combinan con uno de oxígeno para formar una molécula de agua (H2O), un compuesto.
La idea de que los átomos se combinan según proporciones fijas es la base de toda la química moderna, lo que ya hemos hablado.
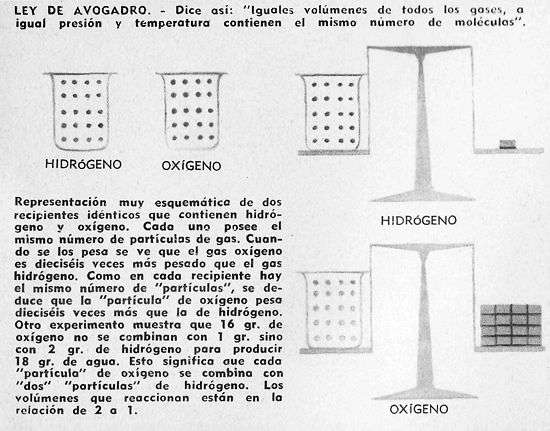
Esta hipótesis, que fue enunciada en 1813 por el físico italiano Amadeo Avogadro, afirma que en volúmenes iguales de todos los gases, medidos en las mismas condiciones de presión y temperatura, hay el mismo número de moléculas. Por ejemplo, un litro de oxígeno y un litro de dióxido de carbono, medidos ambos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas.
En base a esta ley, se comenzó a comparar las masas de dos moléculas distintas, sin necesidad de saber cuantovalen exactamente dichas masas.
Si comparamos un litro de hidrógeno gaseoso y un litro de nitrógeno gaseoso, bajo las mismas condiciones de temperatura y presión, observaremos que el volumen de nitrógeno pesa 14 veces mas que el de hidrógeno, y como ambos volumenes tienen el mismo numero de moléculas, se puede concluir que el peso o masa atómica del nitrogeno es 14 veces la del hidrógeno.
A continuación se muestra una tabla de masa atómica para algunos elementos:
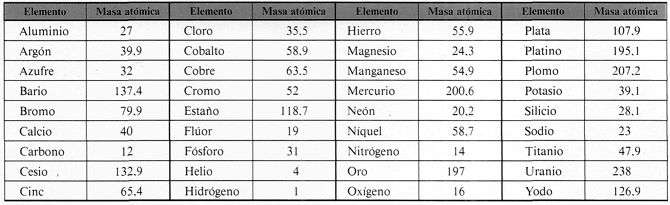
Ejemplo: El ácido sulfúrico (S04H2) está formado por los elementos azufre (S: átomo gramo 32 g), oxígeno (O: átomo gramo 16 g) e hidrógeno (H: átomo gramo 1,0 g).
La Química dice que la fórmula de esta sustancia es S04H2 con lo cual afirma que cada molécula de este ácido tiene un átomo gramo de azufre, 4 átomos gramo de oxígeno y 2 átomos gramo de hidrógeno (cuando el número de átomos gramo es la unidad no se escribe ningún subíndice).
Además, de acuerdo con el significado completo de los símbolos, la fórmula S04H2, representa una masa 1 x 32 + 4 x 16 + 2 x 1,0 = 98 g.
La masa representada, de este modo, por la fórmula, se llama masa de la fórmula.
De acuerdo con esto, la fórmula del ácido sulfúrico nos dice que en 98 g de esta sustancia hay 32 g de azufre, 64 g de oxígeno y 2,0 g de hidrógeno.
A continuación se muestran fórmulas de algunas sustancias muy comunes, juntamente con las masas de sus fórmulas, que puedes calcularla usando la tabla superior de los pesos atómicos.
| Agua | H2O | 18 |
| Hidrógeno | H2 | 2,0 |
| Cloruro de hidrógeno | ClH | 36,5 |
| Oxígeno | O2 | 32,0 |
| Ozono | O3 | 48,0 |
| Dióxido de azufre | SO2 | 64 |
| Trióxido de azufre | SO3 | 80 |
| Ácido sulfúrico | S04H2 | 98 |
| Amoníaco | NH3 | 17 |
| Pentóxido de fósforo | P2O5 | 142 |
| Trióxido de fósforo | P2O3 | 110 |
| Dióxido de carbono | CO2 | 44 |
| Trióxido de aluminio | Al2O3 | 102 |
| Óxido de calcio | CaO | 56 |
| Carbonato de calcio | C03Ca | 100 |
| Óxido cúprico | OCu | 80 |
| Óxido ferroso | OFe | 72 |
| Óxido férrico | 03Fe2 | 160 |
| Óxido mercúrico | OHg | 216 |
| Hidróxido de potasit) | KOH | 56 |
| Hidróxido de sodio | NaOH | 40 |
| Clorato de potasio | Cl03K | 123 |
| Cloruro de sodio | CINa | 58 |
• ►EL MOL:
Los químicos han definido una unidad muy conveniente para comparar la cantidad de partículas que contienen las muestras de sustancias con las que trabajan.
Esta unidad recibe el nombre de mol y representa un número definido de moléculas, átomos, iones, electrones, etc.
De la definición de mol se desprende que el mol de una sustancia pura contiene exactamente el mismo número de moléculas que el mol de otra sustancia pura cualquiera.
Es decir, un mol de metano contiene las mismas moléculas que un mol de ácido sulfúrico, un mol de hidrógeno, etc.
Este número, el número de partículas que contiene un mol, recibe el nombre de número de Avogadro y se representa por NA.
El número de Avogadro tiene un valor de:
NA = 6,02 • 10²³ moléculas/mol
Conocido este valor, se puede calcular el número de moléculas que contiene una muestra cualquiera de una sustancia pura.
Por ejemplo, un mol de agua equivale a 18 g de este compuesto.
Por tanto, un litro de agua (1.000 g de agua) equivaldrá a 1.000/18 = 55,55 moles.
En consecuencia, el número ¿e moléculas que contiene un litro de agua será:
55,55 moles • 6,02 • 10²³ moléculas/mol = 3,34 • 10²5 moléculas
Hemos definido el mol de tal manera que las masas de los moles de las sustancias se encuentran en la misma relación numérica que las masas de las moléculas de dichas sustancias.
Esto tiene una importante consecuencia:
Para medir el mol de una sustancia pura tendremos que tomar tantos gramos de la sustancia como unidades de masa atómica tiene su molécula.
Por ejemplo, como la masa de la molécula de agua es de 18 u, para tener un mol de agua será necesario disponer de 18 gramos de agua; como la masa de la molécula de ácido sulfúrico es de 98 u, para tener un mol de ácido sulfúrico será necesario disponer de 98 gramos de ácido sulfúrico; etc.
EJEMPLO: Sabiendo que la masa atómica del carbono es 12 y la del oxígeno es 16, ¿cuál es la masa molecular del dióxido de carbono? ¿Cuántos moles, moléculas y átom de oxígeno habrá en 132 g de dicho compuesto? ¿Qué volumen ocuparán 2 mi de C02 en en.?
La masa molecular del dióxido de carbono, cuya fórmula es CO2, será la masa atómica del carbono más el doble de la masa atómica del oxígeno: Pm = 12 + 16 x 2 = 44 g/mol
Para calcular la cantidad de sustancia empleamos la relación:
n =m/Pm=132/44= 3 moles de dióxido de carbono
El número de moléculas lo calculamos multiplicando la cantidad de sustancia por el núme de Avogadro:
N.° de moléculas = 3 x 6,022 • 10²³ = 1,807 • 10²4 moléculas de CO2
Como cada molécula de dióxido de carbono tiene dos átomos de oxígeno, el número de átomos de este elemento será el doble que el de moléculas, es decir:
2 x 1,807 • 10²4 = 3,614 • 10²4 átomos de O2
Un mol de cualquier gas en en condiciones normales ocupa 22,4 l.
Por tanto, dos moles ocuparán: 2 • 22,4 = 44,8 l. de CO2
Fuente Consultada:
Revista TECNIRAMA Enciclopedia de la Tecnología N°2
Físico-Química Secundaria Santillana Escudero-Lauzurica-Pascual-Pastor
Elementos de Física y Química Carlos Prelat Editorial Estrada
Temas Relacionados:
Usos de los Rayos Infrarrojos
Efectos de los Rayos Ultravioleta
El Atomo Composicion Energia Nuclear Electrones y Protones
Cálculo del Radio de la Orbita en el Átomo de Hidrógeno
El Atomo Para Niños y Principiantes
Teoría de Desintegración Nuclear del Átomo Radioactividad
Leyes de la Teoría Atómica
Resumen de la Teoria Atomica
Enlace Externo:• Cuáles son los postulados de Dalton?






